Антифриз G13 – виды, свойства, характеристики, преимущества
Главная » Антифриз, тосол
Опубликовано: Рубрика: Антифриз, тосолАвтор: Алексей Назаров
G13 – совершенно новый антифриз, появился несколько лет назад, считается представителем нового поколения охладителей. Его базой служит пропиленгликолевый спирт совместно с различными добавками минерального происхождения.
Применяемые в растворе замедлители пока не имеют установленного названия. Технические жидкости нового образца выпускаются желтого и оранжевого оттенка. Стандарт охладителя VW TL 774 J. Они безопасны для экологии, но отличаются заметной ценой.
Содержание
- Свойства антифриза G13
- Виды
- Антифриз Vag G13
- Motul inugel G13
- Особенности
Свойства антифриза G13
Антифризы – это расходные материалы, которые применяются в охладительной системе силового устройства автомобиля. Главное их предназначение – защита механизмов двигателя от кристаллизации. Кроме охлаждающего свойства, они способны выполнять смазывающую функцию, а также антикоррозийную защиту деталей.
Главное их предназначение – защита механизмов двигателя от кристаллизации. Кроме охлаждающего свойства, они способны выполнять смазывающую функцию, а также антикоррозийную защиту деталей.
Антифриз G13 содержит огромное количество противокоррозионных добавок, что является отличным показателем для жидкости, применяемых в двигателях современного производства. Кроме этого в состав антифриза включены некоторые вкусовые присадки, чтобы потребитель случайно не перепутал составы.
Силикаты, входящие в антифриз, создают на поверхностном слое деталей специальную защитную оболочку, которая препятствует образованию ржавых пятен.
Главным отличием охладителей G13 считается длительный период службы, при условии, что он вливается в новую двигательную систему автомобиля. Если упустить высокую стоимость продукта и экологические составляющие, то охладитель схож по своим техническим свойствам с двухатомным спиртом (этиленгликоль) G12++.
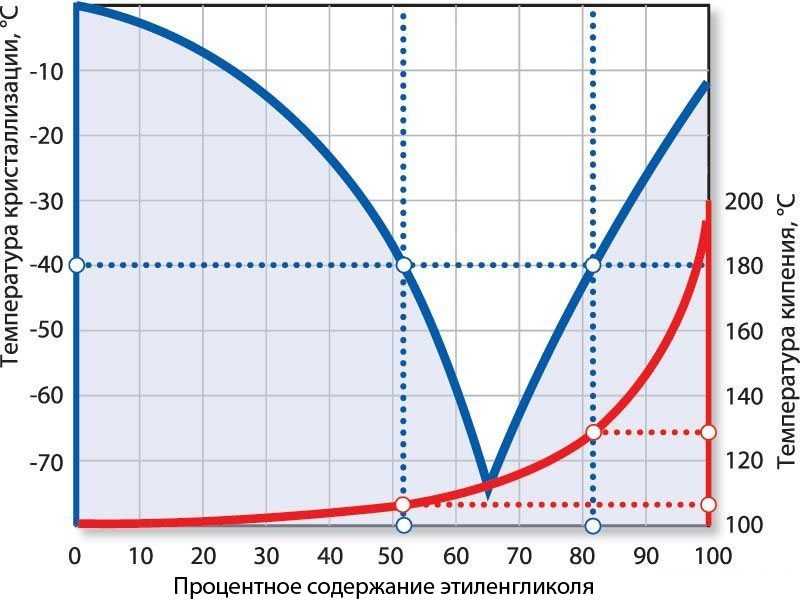
Приобретаемый концентрированный раствор разбавляется очищенной либо дистиллированной водой.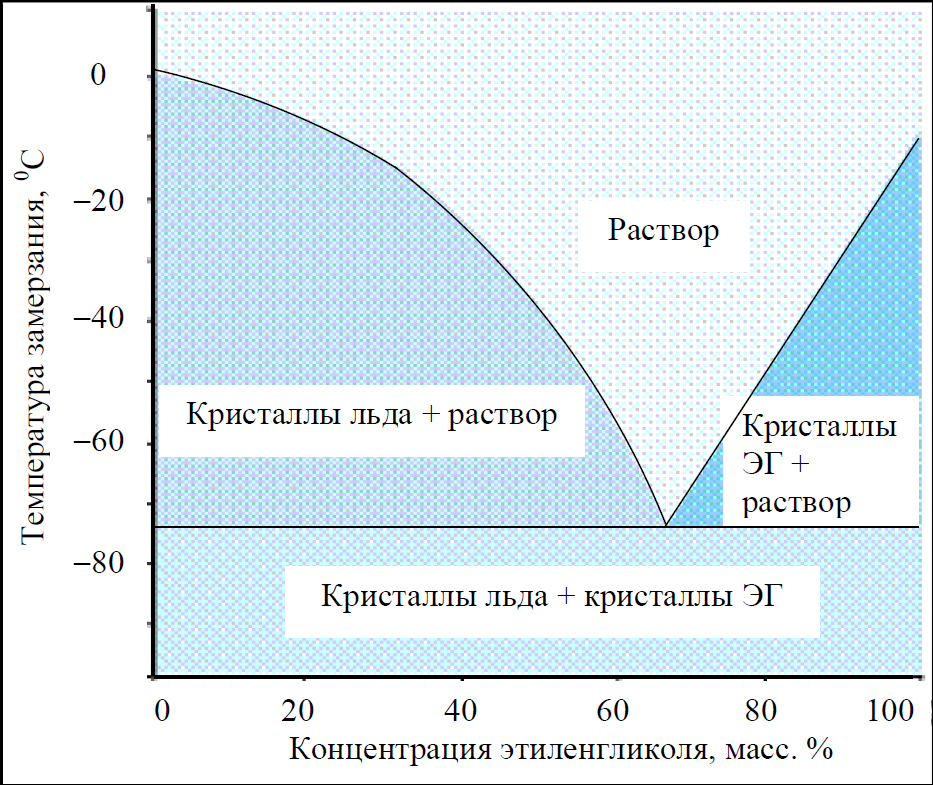 После того как антифриз был разбавлен, у него меняется температурный режим:
После того как антифриз был разбавлен, у него меняется температурный режим:
- Если составы смешиваются в соотношении 1:2, то температура кристаллизации будет равна минус 18 градусов, а закипания – 108 Цельсия;
- При одинаковом соотношении, то есть 1 к 1, то температура замерзания 37 мороза, а точка кипения приблизится к отметке 114 градусов Цельсия.
Антифриз G13 можно смешивать с охладителями более ранних версий, соответствующих стандартам VW TL 774 D, F или G. Именно по этой причине он получил массовость использования в странах Европы.
Виды
Антифриз Vag G13
Техническая смесь, которая уберегает двигатель автомобиля от кристаллизации, коррозионных процессов и температурных скачков одновременно. Применима в любое время года, хорошо сочетается с алюминиевыми двигателями.
Добавки, которые входят в структурный состав технического раствора Vag G13, не агрессивны по отношению к резиновым компонентам, входящих в охлаждающую систему машины.
Антифриз Vag G13 обладает следующими характеристиками:
- Защищает от застывания. Если разбавление концентрата сделано правильно, то температурный диапазон будет варьироваться от 25 до 40 мороза.
- Пожаробезопасен. Точка закипания находится на отметке 135 градусов.
- Препятствует появлению осадков;
- Экологичен.
Motul inugel G13
Охладители Мотюль Инугель G13 выпускаются концентратом, который необходимо разводить водой. Как правило, очищенной или дистиллированной. Базой раствора служит двухатомный спирт этиленгликоль и глицерин с большим количеством добавок органического и неорганического происхождения.
В процессе производства применяется особая схема «Лобрид», которая обеспечивает предельно допустимую защиту механизмов охлаждающей системы и продлевая им срок службы.
По утверждениям производителя, состав рекомендуется использовать в доступной автомобильной линейке Vag. Техническая смесь прекрасно защищает полимерные и металлические поверхности в двигателе от температурных скачков, застывания, извести, ржавления и повышает рабочий срок годности водяного насоса.
Особенности
Как известно, антифризы различаются набором добавляемых в состав компонентов. Эти присадки придают им определенные полезные свойства. Охлаждающий раствор не кристаллизуется под воздействием низких температурных показателей из-за своего химического строения.
Точка кипения у охладителей на несколько градусов выше, чем у обычной воды. По этой причине хладагенты можно применять всесезонно.
Выпускаются современные охладители в различной цветовой гамме, но по оттенку невозможно установить характеристики. Колористика играет лишь вспомогательную функцию – по цвету антифриза легче определить место его протечки.
У каждого производителя свои цветовые решения, поэтому недопустимо смешивать разные составы, ориентируясь только лишь по оттенку. Добавки, вносимые в технический раствор, даже выполняющие аналогичные функции, бывают разными по природе.
Например, в некоторых охладителях в роли поглотителя коррозионных процессов используются минеральные соли, а в других – карбоновые кислоты. При перемешивании они вступят в химическое взаимодействие. В итоге этого смешения образуются отложения, а охлаждающий раствор растеряет свои полезные свойства и станет непригоден для применения.
При перемешивании они вступят в химическое взаимодействие. В итоге этого смешения образуются отложения, а охлаждающий раствор растеряет свои полезные свойства и станет непригоден для применения.
Если автомобиль приобретен через вторые руки либо потребовалось сменить вид антифриза, то перед заливкой необходимо прочистить каналы двигательной системы, то есть промыть. Производить эту процедуру следует специальными средствами.
Алексей Назаров/ автор статьи
Руководитель сети СТО с огромным стажем работы.
Понравилась статья? Поделиться с друзьями:
Антифризы CAT: виды, свойства и варианты замены
26 апреля 2021
316
Если вы владелец парка машин Caterpillar, эксплуатируете дизель-генераторы или другое оборудование этой марки, возникает вопрос: обязательно ли заливать дорогую оригинальную жидкость или можно сэкономить на дешевом антифризе?
Забегая вперед скажем: нет, оригинальную жидкость покупать не обязательно. Но качественную — обязательно. Иначе экономия на спичках выльется в дорогостоящие поломки и простои оборудования.
Иначе экономия на спичках выльется в дорогостоящие поломки и простои оборудования.
Никита Дубровин
Редактор портала
PEAK — поставщик специализированных жидкостей на крупные предприятия, включая российских и западных производителей оригинального оборудования. «В полях» мы насмотрелись на изъеденные кавернами «мокрые» гильзы цилиндра и на то, как выглядит коррозия в системе охлаждения. Поэтому считаем своим долгом рассказать обо всем по порядку:
40 %
поломок двигателя связано с системой охлаждения по данным Cummins® и Caterpillar®
- Почему для тяжело нагруженных двигателей требуются особые антифризы?
- Оригинальные антифризы Cat DEAC, Cat ELC, Cat NGEC — в чем отличие?
- Варианты замены для антифризов Caterpillar
специальные антифризы для тяжело нагруженной техники
В США, на родине марки Caterpillar, существует четкая градация: антифризы для легковых автомобилей и антифризы для грузовых автомобилей и спецтехники (преимущественно с дизельными двигателями). Если в 60–70-х годах прошлого века такая градация была неактуальна: американцы, европейцы, русские, японцы — все использовали примерно одинаковый «тосоло-образный» состав охлаждающих жидкостей, то с развитием техники возникла потребность и в более современных технологиях антифриза. Новый класс карбоксилатных (ОАТ) антифризов отлично зарекомендовал себя для бензиновых двигателей легковых автомобилей и позволил значительно увеличить интервал замены. Однако более теплонагруженные современные дизельные двигатели и форсированные бензиновые двигатели более требовательны к антикоррозионным, антикавитационным и теплоотводящим свойствам антифриза. С одной стороны, это связано с форсировкой (увеличенная степень сжатия, турбо-наддув, прямой впрыск и так далее), с другой — экологичными технологиями, что особенно характерно для тяжелой техники (SCR, EGR, DPF). В моторном отсеке стало жарче не только из-за увеличения температуры в двигателе, но и элементарно из-за уменьшения пространства под капотом.
Если в 60–70-х годах прошлого века такая градация была неактуальна: американцы, европейцы, русские, японцы — все использовали примерно одинаковый «тосоло-образный» состав охлаждающих жидкостей, то с развитием техники возникла потребность и в более современных технологиях антифриза. Новый класс карбоксилатных (ОАТ) антифризов отлично зарекомендовал себя для бензиновых двигателей легковых автомобилей и позволил значительно увеличить интервал замены. Однако более теплонагруженные современные дизельные двигатели и форсированные бензиновые двигатели более требовательны к антикоррозионным, антикавитационным и теплоотводящим свойствам антифриза. С одной стороны, это связано с форсировкой (увеличенная степень сжатия, турбо-наддув, прямой впрыск и так далее), с другой — экологичными технологиями, что особенно характерно для тяжелой техники (SCR, EGR, DPF). В моторном отсеке стало жарче не только из-за увеличения температуры в двигателе, но и элементарно из-за уменьшения пространства под капотом.
«Золотым стандартом» в области специализированных охлаждающих жидкостей для тяжелой техники считаются спецификации ASTM D4985 и ASTM D6210. Если их «младший брат», спецификация ASTM D3306, предписывает требования для бензиновых двигателей среднестатических легковых автомобилей, то старшие по рангу 4985 и 6210 вводят дополнительные испытания. «Грузовой» антифриз должен стабильно работать в условиях повышенных температур в современных дизельных двигателях, задушенных экологичными технологиями. Эти различия в классе антифризов отражены, например, в инструкции по эксплуатации на дизель-генератор Cat C27 / Cat 32:
Подробнее об антифризах для тяжело нагруженных двигателей
Система охлаждения
Рекомендации по выбору охлаждающей жидкости (от Caterpillar)
ПРЕДОСТЕРЕЖЕНИЕ
Не используйте антифриз сторонних производителей, который удовлетворяет требованиям только спецификации ASTM D3306. Данный тип антифриза предназначен для легковых автомобилей, не испытывающих тяжелых нагрузок.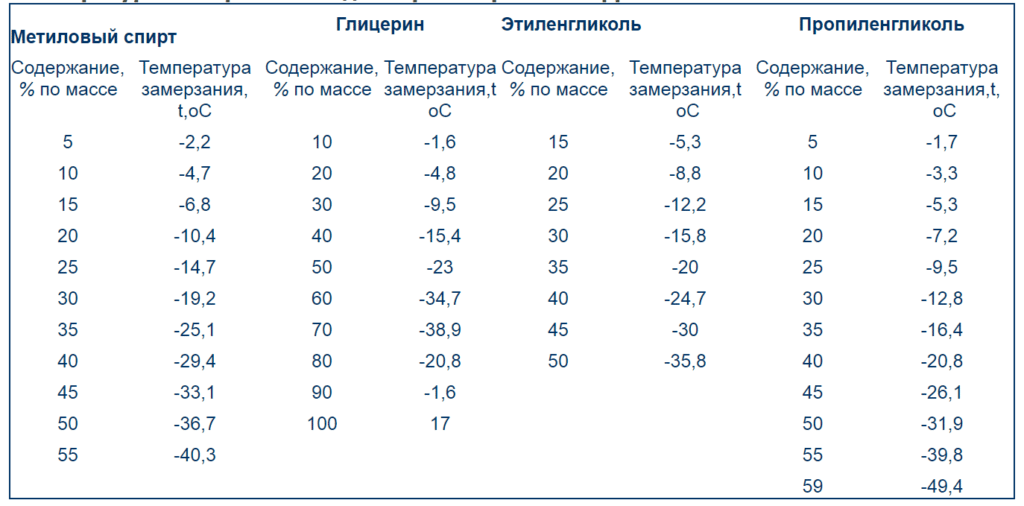 Используйте только рекомендованные охлаждающие жидкости.
Используйте только рекомендованные охлаждающие жидкости.
Cat DEAC, Cat ELC, CAT NGEC:
в чем отличие?
Caterpillar выпускает 2 марки антифриза для самоходных машин: Cat DEAC и Cat ELC. Cat ELC можно использовать как улучшенную версию Cat DEAC, но не наоборот:
не стоит использовать Cat DEAC там, где рекомендуется Cat ELC.
И тем более нельзя смешивать эти два состава. Ещё один тип антифриза предназначен специально для стационарных газовых двигателей: Cat NGEC.
Состав и характеристики Cat DEAC
Cat DEAC содержит гибридный пакет присадок: органические + неорганические. Это «классический» этиленгликолевый антифриз для тяжелой техники: неорганические компоненты обеспечивают дополнительную защиту системы охлаждения от коррозии и кавитации, а органические компоненты позволяют использовать антифриз дольше без потери антикоррозионных свойств.
Цвет: пурпурный (от розового до фиолетового).
Рекомендуемый интервал замены: 3 000 моточасов, 3 года или 200 000 миль (321 869 км).
Техническое обслуживание: рекомендуется долив присадок Cat SCA на каждом ТО (при каждой замене масла) либо по мере необходимости в результате тестирования состояния жидкости. Нормальный pH для этой жидкости: 8,5–10,5.
Концентрация: концентрат.
Соответствие требованиям: ASTM D6210, ASTM D4656, ASTM D3306.
Cat DEAC Концентрат
Состав и характеристики Cat ELC
Cat ELC — антифриз от Caterpillar нового поколения, для которого разработана фирменная спецификация Cat EC-1. Название ELC означает Extended Life Coolant — антифриз увеличенного срока службы. В новых машинах Caterpillar с завода залита именно эта жидкость. Производитель заявляет «усовершенствованный состав, включающий в себя ингибиторы коррозии на основе солей органической кислоты, таких как моно- и дикарбоксилаты». Увеличенный в 4 раза срок службы антифриза и упрощенное техническое обслуживание (не требуется добавление присадок при каждом ТО) обещают экономию средств по сравнению с Cat DEAC (меньше расходов на ТО и меньше простоев).
Цвет: красный.
Рекомендуемый интервал замены: 12 000 м/ч, 6 лет или 600 000 миль (1 000 000 км).
Техническое обслуживание: рекомендуется долив присадок Cat ELI (Extended Life Inhibitor) через 6 000 моточасов или 500 000 км (один раз в течение срока службы жидкости).
Концентрация: 50% (–37 °C) или концентрат.
Соответствие требованиям: Cat EC-1, ASTM D6210, ASTM D3306, TMC RP-329/338, SAE J1034.
Cat ELC Концентрат
Состав и характеристики Cat NGEC
Антифриз Cat NGEC предназначен специально для двигателей на природном газе. Производитель заявляет усиленную защиту от коррозии и питтинга для алюминиевых деталей и оптимизированную формулу, предотвращающую образование пены. Cat NGEC, также как и Cat DEAC, содержит нитриты для защиты от кавитации и требует добавления SCA в ходе технического обслуживания.
Цвет: пурпурный (от розового до фиолетового).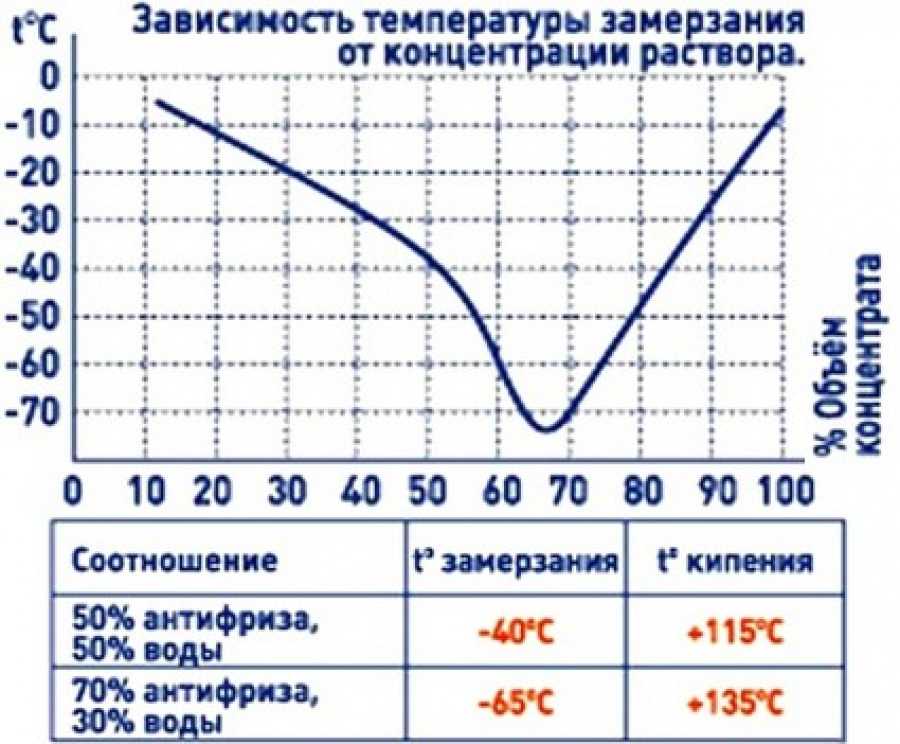
Рекомендуемый интервал замены: 3 000 м/ч или 3 года.
Техническое обслуживание: рекомендуется долив присадок Cat SCA по мере необходимости в результате тестирования состояния жидкости. Нормальный pH: 8,5–10,5.
Концентрация: 50% (–37 °C).
Соответствие требованиям: ASTM D6210, ASTM D4985, ASTM D3306, TMC RP302, TMC RP329.
Cat NGEC 50/50
варианты замены для антифризОВ cat
Caterpillar, в отличие от других производителей техники, не выдаёт официальных допусков для производителей масел и антифризов. Но и не ограничивает пользователя фирменной продукцией. Гарантия на новую технику не будет аннулирована, если вы будете использовать аналоги. Снова обращаемся к инструкции по эксплуатации:
Основные типы охлаждающих жидкостей, используемых в двигателях Caterpillar:
Предпочтительно — Cat ELC (Extended Life Coolant) или антифриз стороннего производителя, соответствующий спецификации Caterpillar EC-1
Допустимо — Cat DEAC (Diesel Engine Antifreeze/Coolant) или антифриз стороннего производителя, соответствующий спецификации ASTM D4985 или ASTM D6210
FLEET CHARGE — замена для Cat DEAC / Cat NGEC
Антифриз FLEET CHARGE соответствует требованиям ASTM D6210 и специально предназначен для тяжело нагруженных дизельных двигателей. FLEET CHARGE используется как первая заливка на заводах Cummins, CNH, MTU, Hyster, Komatsu, Bobcat, Mack, Volvo, Navistar, КАМАЗ. Особую защиту от коррозии и кавитации обеспечивают дополнительные присадки, нитриты и силикаты, которые также как в Cat DEAC требуется добавлять в ходе технического обслуживания. Цвет и варианты концентраций тоже соответствуют антифризу Cat DEAC. Согласно нашим ресурсным испытаниям, FLEET CHARGE при условии грамотного обслуживания системы охлаждения может прослужить до 10 000 моточасов, однако если в вашей сервисной книжке для Cat DEAC (и его заменителей) рекомендуются пробеги в 3 000 моточасов, то рекомендации производителя оборудования имеют преимущество перед рекомендациями производителя антифриза.
FLEET CHARGE используется как первая заливка на заводах Cummins, CNH, MTU, Hyster, Komatsu, Bobcat, Mack, Volvo, Navistar, КАМАЗ. Особую защиту от коррозии и кавитации обеспечивают дополнительные присадки, нитриты и силикаты, которые также как в Cat DEAC требуется добавлять в ходе технического обслуживания. Цвет и варианты концентраций тоже соответствуют антифризу Cat DEAC. Согласно нашим ресурсным испытаниям, FLEET CHARGE при условии грамотного обслуживания системы охлаждения может прослужить до 10 000 моточасов, однако если в вашей сервисной книжке для Cat DEAC (и его заменителей) рекомендуются пробеги в 3 000 моточасов, то рекомендации производителя оборудования имеют преимущество перед рекомендациями производителя антифриза.
Антифриз FLEET CHARGE как и Cat NGEC подходит для эксплуатации в стационарных двигателях на природном газе. Входящие в его состав силикаты обеспечивают превосходную защиту алюминиевых блоков, а специальный агент защищает от вспенивания.
Характеристики FLEET CHARGE
Цвет: розовый.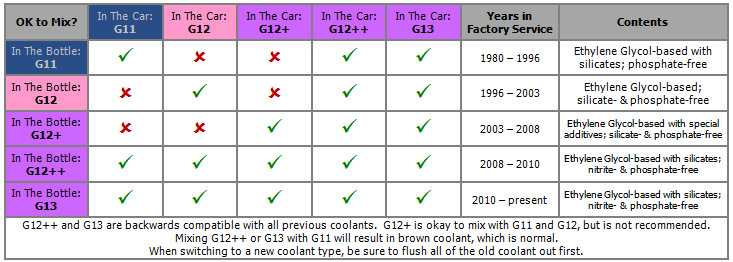
Рекомендуемый интервал замены: до 10 000 моточасов или 200 000 км.
Техническое обслуживание: рекомендуется долив присадок FLEET CHARGE 3 000 через каждые 300 часов работы либо 24 000 км пробега. Если вы используете антифриз FLEET CHARGE, но вам не доступна присадка FLEET CHARGE 3 000, то в качестве замены можно использовать аналоги: Fleetguard DCA2/DCA4, Cat SCA и т.п. Альтернатива доливу присадок — это фильтры системы охлаждения, «заряженные» присадками. Опять же, здесь полная совместимость между «нитритными» фильтрами от Cat, Fleetguard, JCB и так далее. Нормальный pH для этой жидкости = 8,0–11,0.
Концентрация: 50% (–37 °C), 60% (–52 °С), концентрат.
Соответствие требованиям: ASTM D6210, D5345, D4985, D3306, Military CID A-A-52624, TMC RP 329/302C, Cummins 90T8-4, CNH MAT3620, GM 1899M, John Deere h34A1, h34C1, Freightliner 48-22880, Ford ESE-M97B44-A, Navistar B-1 Type II, Volvo Coolant / Mack, ЕЛАЗ (Perkins).
Официальные допуски OEM: Cummins CES 14603, Case New Holland MAT3620, Detroit Diesel 7SE298 / 93K217, Dressta, Liebherr, King Long, MTU MTL 5048, RM-TEREX, Автодизель (ЯМЗ) РД 37.319.037-06 / 12, ДСТ-Урал, КАМАЗ (внутренний допуск), КАМАЗ / КАВЗ / НЕФАЗ / ПАЗ (Cummins), ПРОМТРАКТОР, Ростсельмаш РСМ-142 ХК 22, Тутаевский Моторный Завод.
Соответствие антифриза FINAL CHARGE Global спецификации Cat EC‑1 подтверждено в независимой лаборатории Amalgatech
FINAL CHARGE Global — замена для Cat ELC
FINAL CHARGE Global — антифриз, который прошел сертифицированные испытания на соответствие стандарту Cat EC-1. Изготовлен на основе инновационного пакета присадок, где дополнительную защиту выполняют органические компоненты. Даже по сравнению с Cat ELC обладает увеличенным сроком службы (до 20 000 моточасов), но опять же, предписания инструкции по эксплуатации имеют решающее значение при определении интервала замены. Главное преимущество по сравнению с другими антифризами класса Heavy Duty: FINAL CHARGE Global не требует добавления присадок SCA в течение всего срока службы. Благодаря «долгоиграющим» органическим присадкам не нужно вводить дополнительные присадки помимо тех, которые уже содержатся в антифризе при доливе.
Благодаря «долгоиграющим» органическим присадкам не нужно вводить дополнительные присадки помимо тех, которые уже содержатся в антифризе при доливе.
Характеристики FINAL CHARGE Global
Цвет: красный.
Рекомендуемый интервал замены: 20 000 моточасов, 8 лет или 1 600 000 км.
Техническое обслуживание: не требует ввода дополнительных присадок SCA. Нормальный pH для этой жидкости = 8,0–9,0.
Концентрация: 50% (–37 °C), 60% (–52 °С), концентрат.
Соответствие требованиям: Cat EC-1, ASTM D6210, D7583 (испытание по методу John Deere), D4985, D3306, Military CID A-A-52624, TMC RP 329/302C, John Deere h34A1, h34C1, PACCAR, Volvo ELC / Mack, ЕЛАЗ (Perkins), КАМАЗ (Cummins).
Официальные допуски OEM: AGCO, Cummins CES 14603, Detroit Diesel 7SE298 / 93K217, Dressta, DEUTZ, MAN 324 Typ SNF, Mercedes MB 325.3/326.3, MTU MTL 5048, Navistar CEMS B1 Type IIIa, Автодизель (ЯМЗ) РД 37. 319.037-06 / 12, ДСТ-Урал, КАМАЗ / НЕФАЗ (Daimler), ПРОМТРАКТОР, Тутаевский Моторный Завод.
319.037-06 / 12, ДСТ-Урал, КАМАЗ / НЕФАЗ (Daimler), ПРОМТРАКТОР, Тутаевский Моторный Завод.
артикулы на антифризы ASTM D6210 и присадки sca
Аналоги: Cat DEAC и FLEET CHARGE
Каталожные номера взяты с официальных сайтов производителей. Мы не несем ответственность за возможное изменение артикулов
Аналоги: Cat NGEC и FLEET CHARGE 50/50
Cat SCA и аналоги
артикулы на антифризы cat ec-1 и присадки eli
Аналоги: Cat ELC и FINAL CHARGE Global
Аналоги: Cat ELC Premix и FINAL CHARGE Global 50/50
Присадка: Cat ELI
Если Вам нужна консультация по подбору антифриза или теплоносителя для Вашего оборудования, обратитесь в Службу поддержки PEAK: [email protected] | 8 800 707-17-95
Все торговые марки производителей техники и антифризов приведены исключительно в обучающих целях и принадлежат соответствующим владельцам.
Типы и свойства охлаждающих жидкостей
Дата:
01 августа 2014 г.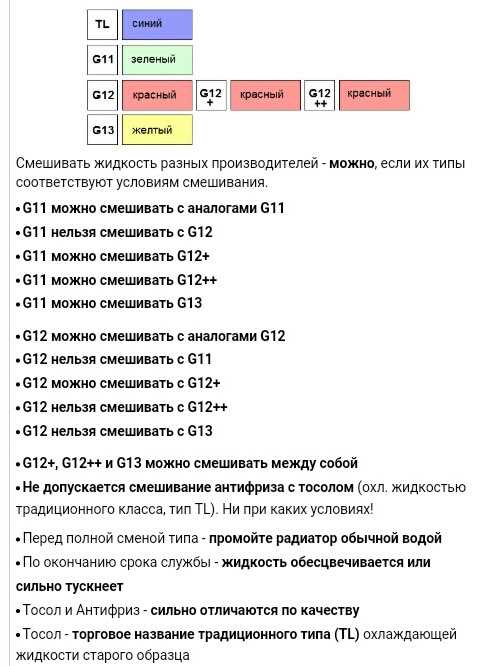
Хладагенты — вещества, с помощью которых теплота от охлаждаемых предметов передается хладагенту.
Основные требования к охлаждающим жидкостям:
- низкая температура замерзания. Она должна быть ниже температуры испарения хладагентов в испарителе на 5-8 градусов;
- большая теплоемкость и теплопроводность;
- низкая вязкость и плотность;
- химическая нейтральность к строительным материалам;
- химическая стойкость и безвредность;
- низкая стоимость и доступность.
Практически нет таких охлаждающих жидкостей, которые полностью удовлетворяли бы предъявляемым требованиям. Самый доступный теплоноситель — вода. Но так как температура замерзания высокая (0°С), то вода используется только в системах кондиционирования и процессах при положительных температурах. При отрицательных температурах обычно применяют водные растворы солей NaCl, CaCl2 и MgCl2 — рассолы.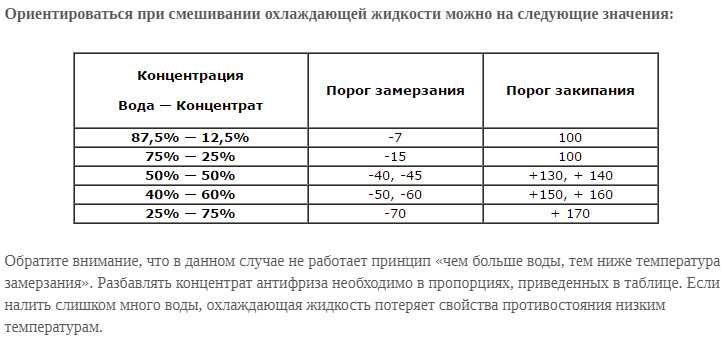
Наиболее широко распространен в качестве охлаждающей жидкости раствор CaCl2. Он также обладает наиболее высокой коррозионной активностью. Необходимым условием возникновения коррозии является наличие кислорода. В открытых системах рассол насыщен кислородом примерно в 4 раза больше, чем в закрытых, вследствие чего коррозия в них протекает значительно сильнее.
С наименьшей скоростью коррозия протекает в растворах, поддерживающих слабощелочную реакцию (рН 7,5-8,5), что достигается добавлением некоторого количества едкого натра и известкового молока. Наиболее эффективным средством является добавление в рассол пассиваторов: силиката натрия, бихромата натрия, фосфорной кислоты. В закрытой системе рассола при использовании тщательно очищенной соли коррозия минимальна.
В рассолы иногда добавляют высокомолекулярные соединения (полиокс или полиакриламид — полимеры линейной структуры) в количестве 0,3-0,07%. Эти соединения способствуют снижению потерь на трение, увеличению производительности насосов и пропускной способности трубопроводов.
В последнее время все чаще в качестве хладагентов используют водные растворы гликолей. Водные растворы этиленгликоля и пропиленгликоля, а также спирты называются антифризами. Они имеют более низкую температуру замерзания, менее агрессивны к материалам конструкции, но при этом дороже.
Найдите компанию-поставщика или торговую марку холодильного оборудования в нашем онлайн-каталоге.
Пожалуйста, поделитесь статьей
13438
Белки-антифризы и их практическое применение в промышленности, медицине и сельском хозяйстве
1. Stevens C.A., Semrau J., Chiriac D., Litschko M., Campbell R.L., Langelaan D.N., Smith S.P., Davies P.L., Allingham J.S. Циркуляризация пептидного остова повышает термостабильность белка-антифриза, Белковая наука: публикация. Белок Соц. 2017;26:1932–1941. doi: 10.1002/pro.3228. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Davies P.L. Белки, связывающие лед: замечательное разнообразие структур для остановки и запуска роста льда. Тенденции биохим. науч. 2014; 39: 548–555. doi: 10.1016/j.tibs.2014.09.005. [PubMed] [CrossRef] [Google Scholar]
3. Bang J.K., Lee J.H., Murugan R.N., Lee S.G. Антифризные пептиды и гликопептиды и их производные: потенциальное использование в биотехнологии.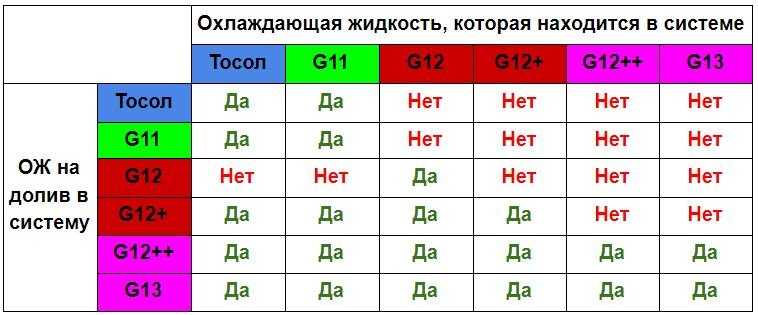
4. Воец И.К. От белков, связывающих лед, до антифризов на биологической основе. Мягкая материя. 2017;13:4808–4823. doi: 10.1039/C6SM02867E. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Флорес А., Куон Дж. К., Перес А. Ф., Ба Ю. Механизмы белков-антифризов исследованы с помощью метода сайт-направленной спиновой маркировки. Евро. Биофиз. Дж. 2018; 47:611–630. doi: 10.1007/s00249-018-1285-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Ким Х.Дж., Ли Дж.Х., Хур Ю.Б., Ли К.В., Пак С.Х. Морские белки-антифризы: структура, функции и применение для криоконсервации в качестве потенциального криопротектора. Мар. Наркотики. 2017;15:27. doi: 10.3390/md15020027. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Balcerzak A.K., Capicciotti C.J., Briard J.G., Ben R.N. Разработка ингибиторов рекристаллизации льда: от белков-антифризов (глико) до малых молекул. Р. Соц. хим. Доп. 2014;4:42682–42696. дои: 10.1039/C4RA06893A. [CrossRef] [Google Scholar]
Р. Соц. хим. Доп. 2014;4:42682–42696. дои: 10.1039/C4RA06893A. [CrossRef] [Google Scholar]
8. Laezza A., Casillo S., Cosconati C.I., Biggs A., Fabozzi L., Paduano A., Iadonisi E., Novellino M.I., Gibson A., Corsaro M.M., et al. . Декорирование полисахарида хондроитина треонином: синтез, конформационное исследование и активность ингибирования перекристаллизации льдом. Биомакромолекулы. 2017;18:2267–2276. doi: 10.1021/acs.biomac.7b00326. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Kristiansen E., Zachariassen K.E. Механизм, с помощью которого антифризные белки рыб вызывают тепловой гистерезис. Криобиология. 2005; 51: 262–280. doi: 10.1016/j.cryobiol.2005.07.007. [PubMed] [CrossRef] [Академия Google]
10. Xiang H., Yang X., Ke L., Hu Y. Свойства, биотехнологии и применение белков-антифризов. биол. макромол. 2020; 153: 661–675. doi: 10.1016/j.ijbiomac.2020.03.040. [PubMed] [CrossRef] [Google Scholar]
11. Celik Y., Drori R., Pertaya-Braun N. , Altan A., Barton T. Микрожидкостные эксперименты показывают, что антифризных белков, связанных с кристаллами льда, достаточно, чтобы предотвратить их рост. . проц. Натл. акад. науч. США. 2013; 110:1309–1314. doi: 10.1073/pnas.1213603110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Altan A., Barton T. Микрожидкостные эксперименты показывают, что антифризных белков, связанных с кристаллами льда, достаточно, чтобы предотвратить их рост. . проц. Натл. акад. науч. США. 2013; 110:1309–1314. doi: 10.1073/pnas.1213603110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Кавахара Х. Характеристика функций биологических материалов, обладающих способностью контролировать рост кристаллов льда. Матер. науч. 2012 г.: 10.5772/54535. [CrossRef] [Google Scholar]
13. Hayward J.A., Haymet A.D.J. Поверхность раздела лед/вода: молекулярно-динамическое моделирование базальной, призменной, {2021} и {2110} границ раздела льда Ih. хим. физ. 2001; 114:3713–3726. дои: 10.1063/1.1333680. [CrossRef] [Google Scholar]
14. Оливе Л.Л., Мейстер К., ДеВриес А.Л., Думан Л.Г., Го С., Баккер Х.Дж., Воетс Л.И. Блокирование быстрого роста кристаллов льда за счет небазальной адсорбции белков-антифризов. проц. Натл. акад. науч. США. 2016;113:3740–3745. doi: 10. 1073/pnas.1524109113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1073/pnas.1524109113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Kuiper M.J., Lankin C., Gauthier S.Y., Walker V.K., Davies P.L. Очистка антифризных белков адсорбцией на льду. Биохим. Биофиз. Рез. коммун. 2003; 300: 645–648. doi: 10.1016/S0006-291X(02)02900-5. [PubMed] [CrossRef] [Google Scholar]
16. Ding X., Zhang H., Chen H.L., Wang H., Qian X. Экстракция, очистка и идентификация белков-антифризов из акклиматизированного к холоду пивоваренного ячменя ( Hordeum vulgare Л.) Пищевая хим. 2015; 175:74–81. doi: 10.1016/j.foodchem.2014.11.027. [PubMed] [CrossRef] [Google Scholar]
17. Mao M.G., Chen Y., Liu R.T., Lu H.Q., Gu J. Транскриптом из печени тихоокеанской трески раскрывает типы аполипопротеинов и анализ экспрессии AFP-IV, структурного аналога с ApoA-I млекопитающих, Сравнительная биохимия и физиология. Часть D Геном. протеом. 2018;28:204–212. doi: 10.1016/j.cbd.2018.10.001. [PubMed] [CrossRef] [Google Scholar]
18. Sharma B. , Sahoo D., Deswal R. Одностадийная очистка и характеристика белков-антифризов из листьев и ягод морозостойкого кустарника облепихи ( Hippophae rhamnoides ) Sep. Sci. 2018;41:3938–3945. doi: 10.1002/jssc.201800553. [PubMed] [CrossRef] [Google Scholar]
, Sahoo D., Deswal R. Одностадийная очистка и характеристика белков-антифризов из листьев и ягод морозостойкого кустарника облепихи ( Hippophae rhamnoides ) Sep. Sci. 2018;41:3938–3945. doi: 10.1002/jssc.201800553. [PubMed] [CrossRef] [Google Scholar]
19. Cheng J., Hanada Y., Miura A., Tsuda S., Kondo H. Гидрофобные участки связывания со льдом придают гиперактивность антифризного белка гриба снежной плесени. Биохим. J. 2016 doi: 10.1042/BCJ20160543. [PubMed] [CrossRef] [Google Scholar]
20. Basu K., Garnham C.P., Nishimiya Y., Tsuda S., Braslavsky I. Определение плоскостей связывания со льдом белков-антифризов с помощью флуоресцентной аффинности ледяных плоскостей. Вис. Эксп. 2014;83:e51185. дои: 10.3791/51185. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Knight C.A., Cheng C.C., DeVries AL. Адсорбция альфа-спиральных антифризных пептидов на определенных плоскостях поверхности кристаллов льда. Биофиз, Дж. 1991; 59: 409–418. doi: 10.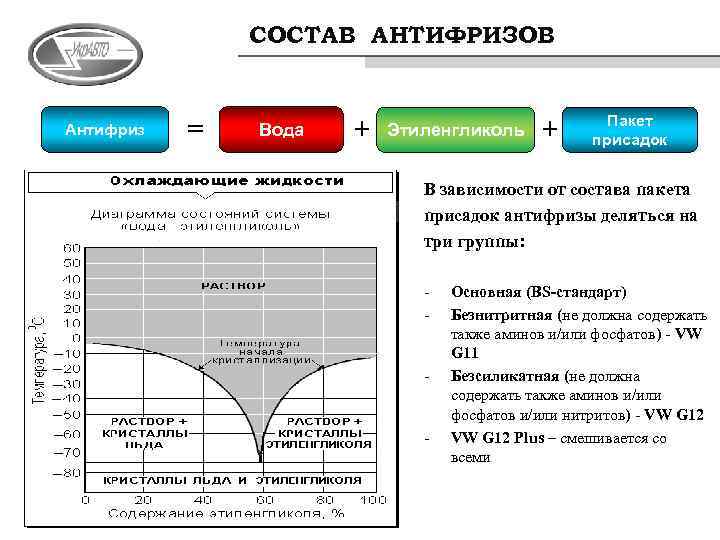 1016/S0006-3495(91)82234-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
1016/S0006-3495(91)82234-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
22. Халева Л., Челик Ю., Бар-Долев М., Пертая-Браун Н., Канер А., Дэвис П.Л. Микрожидкостное устройство холодного пальца для исследования белков, связывающих лед. Biophys J. 2016; 111:1143–1150. doi: 10.1016/j.bpj.2016.08.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Cheng Y., Yang Z., Tan H., Liu R., Chen G., Jia Z. Анализ участков связывания льда в антифризовом белке рыб типа II с помощью квантовой механики. Биофиз Дж. 2002; 83: 2202–2210. doi: 10.1016/S0006-3495(02)73980-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Loewen M.C., Gronwald W., Sönnichsen F.D., Sykes B.D., Davies P.L. Сайт связывания льда антифризного белка морского ворона отличается от сайта связывания углеводов гомологичного лектина С-типа. Биохим. Дж. 1998;37:17745–17753. doi: 10.1021/bi9820513. [PubMed] [CrossRef] [Google Scholar]
25. Knight C.A., Hallett J. , DeVries A.L. Влияние растворенных веществ на рекристаллизацию льда: метод оценки. Криобиология. 1988; 21: 55–60. doi: 10.1016/0011-2240(88)
, DeVries A.L. Влияние растворенных веществ на рекристаллизацию льда: метод оценки. Криобиология. 1988; 21: 55–60. doi: 10.1016/0011-2240(88)
26. Tomczak M.M., Marshall C.B., Gilbert J.A., Davies P.L. Простой метод определения ингибирования рекристаллизации льда антифризными белками. BBRC J. 2003; 311: 1041–1046. doi: 10.1016/j.bbrc.2003.10.106. [PubMed] [CrossRef] [Академия Google]
27. Стаббс С., Уилкинс Л.Е., Файтер А.Э.Р., Уокер М., Гибсон М.И. Мультивалентная презентация полимеров, ингибирующих рекристаллизацию льда, на наночастицах сохраняет активность. Являюсь. хим. соц. 2018; 35:7347–7353. doi: 10.1021/acs.langmuir.8b01952. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Yu S.-H., Yang P., Sun T., Qi Q., Wang X.-Q., Chen X.M., Feng Y , Транскриптомный и протеомный анализ способности к суперохлаждению и добыче антифризных белков китайской белой восковой щитовки. наук о насекомых. 2016; 23:430–437. дои: 10.1111/1744-7917.12320. [PubMed] [CrossRef] [Google Scholar]
дои: 10.1111/1744-7917.12320. [PubMed] [CrossRef] [Google Scholar]
29. Карраско М.А., Бюхлер С.А., Арнольд Р.Дж., Сформо Т., Барнс Б.М. Исследование способности к глубокому переохлаждению жука с Аляски Cucujus clavipes puniceus с помощью высокопроизводительной протеомики. протеом. Дж. 2012; 75:1220–1234. doi: 10.1016/j.jprot.2011.10.034. [PubMed] [CrossRef] [Google Scholar]
30. Кумар М., Салдана Х., Кумар Р., Бхаттачарья Х., Соуза Н. In-Silco анализ антифризных белков рыб и их физико-химическая характеристика. Чистое приложение. Бионауч. 2018;1:1392–1398. doi: 10.18782/2320-7051.6354. [CrossRef] [Google Scholar]
31. Wellig S., Hamm P. Спасительный слой антифризных белков анализируется с помощью марковской модели состояния. физ. хим. Дж. 2018;49:11014–11022. doi: 10.1021/acs.jpcb.8b04491. [PubMed] [CrossRef] [Google Scholar]
32. Doxey A.C., Yaish M.W., Griffith M., McConkey B.J. Упорядоченные поверхностные углероды различают белки-антифризы и их участки, связывающие лед.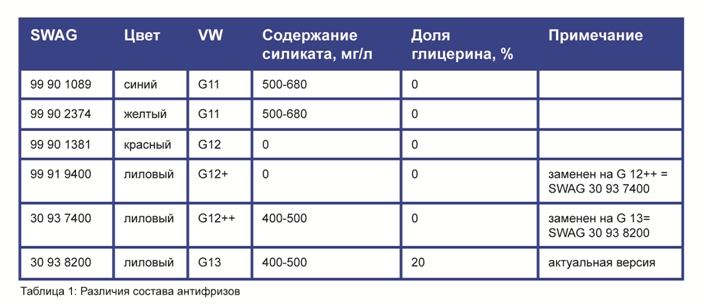 Нац. Биотехнолог. 2006; 24:852–855. doi: 10.1038/nbt1224. [PubMed] [CrossRef] [Академия Google]
Нац. Биотехнолог. 2006; 24:852–855. doi: 10.1038/nbt1224. [PubMed] [CrossRef] [Академия Google]
33. Кандасвами К.К., Чоу К.С., Мартинец Т., Моллер С., Сугантан П.Н. AFP-Pred: метод случайного леса для прогнозирования белков-антифризов по свойствам, полученным из последовательности. Теор. биол. 2011; 270:56–62. doi: 10.1016/j.jtbi.2010.10.037. [PubMed] [CrossRef] [Google Scholar]
34. Xiao X., Hui M., Liu Z. iAFP-Ense: ансамблевый классификатор для идентификации антифризного белка путем включения модели Грея и PSSM в PseAAC. член биол. 2016; 249:845–854. doi: 10.1007/s00232-016-9935-9. [PubMed] [CrossRef] [Google Scholar]
35. He X., Han K., Hu J., Yan H., Yang J.Y., Shen H.B., Yu D.J. Целевая заморозка: идентификация белков-антифризов с помощью комбинации весов с использованием информации об эволюции последовательности и псевдоаминокислотного состава. член биол. 2015; 248:1005–1014. doi: 10.1007/s00232-015-9811-z. [PubMed] [CrossRef] [Google Scholar]
36. Nadu T. Оценка методов прогнозирования вторичной структуры белка in-silico с использованием статистических методов. Биомед. Биотехнолог. Рез. Дж. 2017; 5:29–36. doi: 10.4103/bbrj.bbrj_28_17. [CrossRef] [Google Scholar]
Nadu T. Оценка методов прогнозирования вторичной структуры белка in-silico с использованием статистических методов. Биомед. Биотехнолог. Рез. Дж. 2017; 5:29–36. doi: 10.4103/bbrj.bbrj_28_17. [CrossRef] [Google Scholar]
37. Бхаттачари М., Хота А., Кар А., Чини Д.С., Малик Р.К. In-silico Структурное и функциональное моделирование последовательностей антифризного белка (АФП) морского петуха ( Zoarces americanus , Bloch & Schneider 1801) Genet. англ. Биотехнолог. 2018;16:721–730. doi: 10.1016/j.jgeb.2018.08.004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Мушараф М.Д. Антифризные белки рыб: вычислительный анализ и физико-химическая характеристика. Междунар. Курс. фарм. 2012; 1:18–26. дои: 10.3329/icpj.v1i2.9412. [CrossRef] [Google Scholar]
39. Идрис С., Надим С., Канвал С., Эхсан Б., Юсаф А., Надим С., Райока М.И. Анализ последовательности in silico, моделирование гомологии и функциональная аннотация гипотетического белка G1CT28_OCIBA Ocimum basilicum . Биоавтоматизация. 2012;16:111–118. [Google Scholar]
Биоавтоматизация. 2012;16:111–118. [Google Scholar]
40. Долев Б., Браславский М., Дэвис П.Л. Белки, связывающие лед, и их функции. Анну. Преподобный Биохим. 2016; 85: 515–542. doi: 10.1146/annurev-biochem-060815-014546. [PubMed] [CrossRef] [Академия Google]
41. Цзя З., Дэвис П.Л. Белки-антифризы: необычное взаимодействие рецептор-лиганд. Тенденции биохим. науч. 2002; 27:101–106. doi: 10.1016/S0968-0004(01)02028-X. [PubMed] [CrossRef] [Google Scholar]
42. Чакраборти С., Биман Дж. Необычная история о структурной эволюции, гидратации и функциях. проц. Индийская национальная наука. акад. 2018;1:169–187. doi: 10.16943/ptinsa/2018/49553. [CrossRef] [Google Scholar]
43. Mahatabuddin S., Hanada Y., Nishimiya Y., Miura A. Зависимая от концентрации олигомеризация альфа-спирального антифризного полипептида делает его гиперактивным. науч. 2017;7:42501. doi: 10.1038/srep42501. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Нисимия Ю., Кондо Х. , Такамичи М., Сугимото Х., Судзуки М., Миура А., Цуда С. Кристаллическая структура и мутационный анализ Ca 2+ -независимого антифризного белка II типа из длинной браконьер, Brachyopsis rostratus . Мол. биол. 2008; 382: 734–746. doi: 10.1016/j.jmb.2008.07.042. [PubMed] [CrossRef] [Google Scholar]
, Такамичи М., Сугимото Х., Судзуки М., Миура А., Цуда С. Кристаллическая структура и мутационный анализ Ca 2+ -независимого антифризного белка II типа из длинной браконьер, Brachyopsis rostratus . Мол. биол. 2008; 382: 734–746. doi: 10.1016/j.jmb.2008.07.042. [PubMed] [CrossRef] [Google Scholar]
45. Рудсари Х., Гофф Х.Д. Ледяные структурирующие белки растений: механизм действия и применение в пищевых продуктах. Еда Рез. 2012; 46: 425–436. doi: 10.1016/j.foodres.2011.12.018. [Перекрестная ссылка] [Академия Google]
46. Huang Q., Hu R., Zhu H., Peng C., Chen L. Холодостойкая активность мультидоменного антифризного белка типа III из антарктической бельдюги Lycodrchths deaborni , обнаруженная в трансгенных табаках. Аква. Рыбы. 2019: 1–6. doi: 10.1016/j.aaf.2019.11.006. [CrossRef] [Google Scholar]
47. Sönnichsen F.D., DeLuca C.I., Davies P.L., Sykes B.D., Sönnichsen F.D., DeLuca C.I., Davies P.L., Sykes B.D. Усовершенствованная структура раствора антифриза III типа: гидрофобные группы могут быть вовлечены в энергетику взаимодействия белок-лед. Структура. 1996;4:1325–1337. doi: 10.1016/S0969-2126(96)00140-2. [PubMed] [CrossRef] [Google Scholar]
Структура. 1996;4:1325–1337. doi: 10.1016/S0969-2126(96)00140-2. [PubMed] [CrossRef] [Google Scholar]
48. Урбанчик М., Гора Дж., Латайка Р., Норберт С. Антифризные гликопептиды: от структуры и структуры активности до современных подходов в химическом синтезе. Аминокислоты. 2017;49:209–222. doi: 10.1007/s00726-016-2368-z. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
49. Думан Дж. С. Белки и гликопептиды, связывающие лед животных (белки-антифризы). Эксп. биол. 2015; 218:1846–1855. дои: 10.1242/jeb.116905. [PubMed] [CrossRef] [Google Scholar]
50. Ye Q., Eves R., Campbell R.L., Davies P.L. В кристаллической структуре белков-антифризов насекомых обнаруживаются упорядоченные воды на связывающей лед поверхности. Биохим. 2020;17:3271–3286. doi: 10.1042/BCJ20200539. [PubMed] [CrossRef] [Google Scholar]
51. Брайон А., Вибоу Н., Дермау В. Анализ экспрессии генов в геноме факультативных репродуктивных диапауз у двупятнистого паутинного клеща. БМС Геном. 2013;14:815. дои: 10.1186/1471-2164-14-815. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2013;14:815. дои: 10.1186/1471-2164-14-815. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Гуз Н., Топрак У., Дагери А. Идентификация предполагаемого гена антифризного белка, который сильно экспрессируется во время подготовки к зиме у солнечных вредителей. Физиол насекомых. 2014;68:30–35. doi: 10.1016/j.jinsphys.2014.06.021. [PubMed] [CrossRef] [Google Scholar]
53. Hon W., Griffith M., Chong P., Yang D.S.C. Экстракция и выделение белков-антифризов из листьев озимой ржи ( Secale злаковый L.). Завод Физиол. Бетесда. 1994; 104: 971–980. дои: 10.1104/стр.104.3.971. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Provesi J.G., Volentim P.A., Arisi A.C.M. Белки-антифризы в естественно акклиматизированных к холоду листьях Drimys angustifolia , Senecio icoglossus и Eucalyptus ssp. Пищевая Технол. 2016;19:e2016110. дои: 10.1590/1981-6723.11016. [CrossRef] [Google Scholar]
55. Муньос П. А., Маркес С.Л., Гонсалес Ф.Д. Структура и применение белков-антифризов антарктических бактерий. микроб. Клеточные фабрики. 2017;16:138–150. дои: 10.1186/с12934-017-0737-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
А., Маркес С.Л., Гонсалес Ф.Д. Структура и применение белков-антифризов антарктических бактерий. микроб. Клеточные фабрики. 2017;16:138–150. дои: 10.1186/с12934-017-0737-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Устун Н.С., Турхан С. Белки-антифризы: характеристики, механизмы действия, источники и применение в пищевых продуктах. Пищевой процесс. Сохранить 2015;39:3189–3197. doi: 10.1111/jfpp.12476. [CrossRef] [Google Scholar]
57. Boonsupthip W., Lee T.C. Применение белка-антифриза для консервирования пищевых продуктов: Эффект белка-антифриза III типа для сохранения гелеобразующего замороженного и охлажденного актомиозина. Пищевая наука. 2003; 68: 1804–1809.. doi: 10.1111/j.1365-2621.2003.tb12333.x. [CrossRef] [Google Scholar]
58. Пейн С.Р., Янг О.А. Влияние предубойного введения белков-антифризов на качество замороженного мяса. Мясная наука. 1995; 41: 147–155. doi: 10.1016/0309-1740(94)00073-G. [PubMed] [CrossRef] [Google Scholar]
59. Ding X., Zhang H., Liu W., Wang L., Qian H. Извлечение антифризных белков моркови ( Daucus carota ) и оценка их воздействия на замороженная белая соленая лапша. Технология пищевых биопроцессов. 2014;7:842–852. дои: 10.1007/s11947-013-1101-0. [CrossRef] [Google Scholar]
Ding X., Zhang H., Liu W., Wang L., Qian H. Извлечение антифризных белков моркови ( Daucus carota ) и оценка их воздействия на замороженная белая соленая лапша. Технология пищевых биопроцессов. 2014;7:842–852. дои: 10.1007/s11947-013-1101-0. [CrossRef] [Google Scholar]
60. Zhang C., Zhang H., Wang L., Gao H., Guo X.N. Влияние белков-антифризов моркови на консистенцию и свойства замороженного теста и летучих соединений мякиша. Пищевая наука. Технол. 2007;41:1029–1036. doi: 10.1016/j.lwt.2007.07.010. [CrossRef] [Google Scholar]
61. Чжан С., Чжан Х., Ван Л. Влияние антифризных белков моркови ( Daucus carota ) на ферментативную способность замороженного теста. Еда Рез. Междунар. 2007; 40: 763–769.. doi: 10.1016/j.foodres.2007.01.006. [CrossRef] [Google Scholar]
62. Панадеро Дж., Рандес Ф., Прието Дж.А. Гетерологическая экспрессия антифризного пептида I типа GS-5 в пекарских дрожжах повышает устойчивость к замораживанию и обеспечивает повышенное газообразование в замороженном тесте. Агр. Пищевая хим. 2005; 53:9966–9970. doi: 10.1021/jf0515577. [PubMed] [CrossRef] [Google Scholar]
Агр. Пищевая хим. 2005; 53:9966–9970. doi: 10.1021/jf0515577. [PubMed] [CrossRef] [Google Scholar]
63. Xu H.-N., Huang W., Jia C., Kim Y., Liu H. Оценка водоудерживающей способности и хлебопекарных свойств замороженного теста, содержащего лед структурирование белков озимой пшеницы. Зерновые науки. 2009 г.;49:250–253. doi: 10.1016/j.jcs.2008.10.009. [CrossRef] [Google Scholar]
64. Liu M., Liang Y., Zhang H., Wu G., Wang L., Qian H. Производство рекомбинантного антифризного белка моркови с помощью Pichia pastoris GS115 и его криопротектора. влияние на свойства замороженного теста и качество хлеба. Пищевая наука. Технол. 2018;96:543–550. doi: 10.1016/j.lwt.2018.05.074. [CrossRef] [Google Scholar]
65. Шейх М., Цуда С. Применение белков-антифризов: Практическое использование качественных продуктов из японских рыб. Доп. Эксп. Мед. биол. 2018;13:321–337. дои: 10.1007/978-981-13-1244-1_17. [PubMed] [CrossRef] [Google Scholar]
66. Фукусима М., Цуда С. , Йошизава Ю. Изготовление высокопористого оксида алюминия, полученного методом замораживания желатина с антифризным белком. Являюсь. Керам. соц. 2013;96:1029–1031. doi: 10.1111/jace.12229. [CrossRef] [Google Scholar]
, Йошизава Ю. Изготовление высокопористого оксида алюминия, полученного методом замораживания желатина с антифризным белком. Являюсь. Керам. соц. 2013;96:1029–1031. doi: 10.1111/jace.12229. [CrossRef] [Google Scholar]
67. Гвак Ю., Пак Дж.И., Ким М., Ким Х.С., Квон М.Дж., О С.Дж., Ким Ю.П., Джин Э.С. Создание антиобледенительных поверхностей путем прямой иммобилизации антифризных белков на алюминии. Нац. науч. Отчет 2015; 5: 1038–1046. doi: 10.1038/srep12019. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Chen Z., Huang C.Y., Zhao M., Yan W., Chien C.W., Chen M., Yang H., Machiyama H., Lin S. Характеристики и возможное происхождение самородного алюминия в отложениях холодного просачивания с северо-востока Южно-Китайского моря. заявл. науч. вычисл. 2011;40:363–370. doi: 10.1016/j.jseaes.2010.06.006. [CrossRef] [Google Scholar]
69. Gwak I.G., sic Jung W., Kim HJ, Kang S.H., Jin E. Белок-антифриз в антарктических морских диатомовых водорослях, Chaetoceros neogracile. Мар. Биотехнолог. 2010;12:630–639. doi: 10.1007/s10126-009-9250-x. [PubMed] [CrossRef] [Google Scholar]
Мар. Биотехнолог. 2010;12:630–639. doi: 10.1007/s10126-009-9250-x. [PubMed] [CrossRef] [Google Scholar]
70. Gwak Y., Jung W., Lee Y., Kim J.S., Kim C.G., Ju J.H., Song C., Hyun J.K., Jin E. Внутриклеточный белок-антифриз из Антарктическая микроводоросль, реагирующая на различные стрессы окружающей среды. FASEB J. 2014; 28:4924–4935. doi: 10.1096/fj.14-256388. [PubMed] [CrossRef] [Google Scholar]
71. Kreilgaard L., Frokjaer S., Flink J.M., Randolph T.W., Carpenter J.F. Влияние добавок на стабильность рекомбинантного человеческого фактора XIII во время сублимационной сушки и хранения в высушенном Твердый. Арка Биохим. Биофиз. 1998;360:121–134. doi: 10.1006/abbi.1998.0948. [PubMed] [CrossRef] [Google Scholar]
72. Кошик Дж. К., Бхат Р. Почему трегалоза является исключительным стабилизатором белка? Анализ термостабильности белков в присутствии совместимого осмолита трегалозы. биол. хим. 2003; 278:26458–26465. doi: 10.1074/jbc.M300815200. [PubMed] [CrossRef] [Google Scholar]
73. Учида Т., Нагаяма М., Гохара К. Вязкость раствора трегалозы при низких температурах, измеренная методом динамического рассеяния света: трегалоза подавляет молекулярный транспорт для роста кристаллов льда. Дж. Крист. Рост. 2009 г.;311:4747–4752. doi: 10.1016/j.jcrysgro.2009.09.023. [CrossRef] [Google Scholar]
Учида Т., Нагаяма М., Гохара К. Вязкость раствора трегалозы при низких температурах, измеренная методом динамического рассеяния света: трегалоза подавляет молекулярный транспорт для роста кристаллов льда. Дж. Крист. Рост. 2009 г.;311:4747–4752. doi: 10.1016/j.jcrysgro.2009.09.023. [CrossRef] [Google Scholar]
74. Фикриг Э., Эйзинг М., Абрахам Н., Нилаканта Г. Противоинфекционные свойства белка-антифриза. 10792332B2. Патент США. 2020 6 октября;
75. Heisig M., Agaisse H., Fikrig E. Антивирулентные свойства белка-антифриза. Клеточный пресс. 2014; 9: 417–424. doi: 10.1016/j.celrep.2014.09.034. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
76. Ярели М., Рамос Л. Биология выживания клеток на холоде: Основы биосохранения тканей и органов. Доп. Биоконсерв. 2010;96:15–62. [Google Scholar]
77. Абрахам Н.М., Лю Л., Ютрас Б.Л., Мерфин К., Акар А., Яровинский Т.О., Саттон Э., Хейзиг М., Джейкобс-Вагнер К. Антивирулентный белок клеща усиливает действие антибиотиков против Золотистый стафилококк .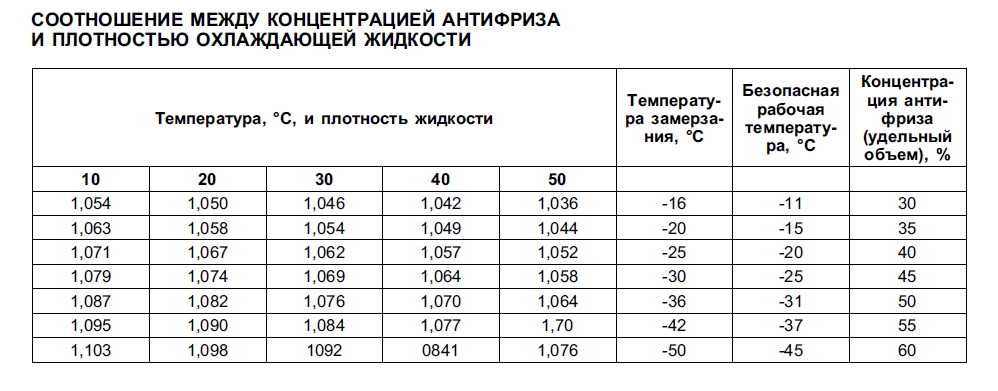 Антимикроб. Агенты Чемотер. 2017; 61 doi: 10.1128/AAC.00113-17. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Антимикроб. Агенты Чемотер. 2017; 61 doi: 10.1128/AAC.00113-17. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Ли Дж., Ким С.К., Юм Х.В., Ким Х.Дж., Ли Дж.Р. Влияние трех различных типов белков-антифризов на криоконсервацию и трансплантацию ткани яичников мышей. ПЛОС ОДИН. 2015;10:1371–1385. doi: 10.1371/journal.pone.0126252. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Куваяма М., Вайта Г., Като О., Лабо С. Высокоэффективный метод витрификации для криоконсервации ооцитов человека. Воспр. биомед. В сети. 2005; 11: 300–308. doi: 10.1016/S1472-6483(10)60837-1. [PubMed] [CrossRef] [Google Scholar]
80. Кратохвилова И., Копечна О., Бачикова А., Пагачова Е., Фалькова И., Эллиотт С.Е. Изменения ядер криоконсервированных клеток служат индикаторами процессов при замораживании и оттаивании. Ленгмюр. 2019; 35:7496–7508. doi: 10.1021/acs.langmuir.8b02742. [PubMed] [CrossRef] [Академия Google]
81. Yang J., Pan C., Zhang J., Sui X. , Zhu Y., Wen C., Zhang L. Изучение потенциала биосовместимых осмопротекторов как высокоэффективных криопротекторов. Являюсь. хим. науч. заявл. Матер. 2017;9:42516–42524. doi: 10.1021/acsami.7b12189. [PubMed] [CrossRef] [Google Scholar]
, Zhu Y., Wen C., Zhang L. Изучение потенциала биосовместимых осмопротекторов как высокоэффективных криопротекторов. Являюсь. хим. науч. заявл. Матер. 2017;9:42516–42524. doi: 10.1021/acsami.7b12189. [PubMed] [CrossRef] [Google Scholar]
82. Карпентер Ф.Дж., Хансен Т.Н. Белок-антифриз модулирует выживаемость клеток во время криоконсервации: опосредование через влияние на рост кристаллов льда. Физиология. 1992; 89: 8953–8957. doi: 10.1073/pnas.89.19.8953. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
83. Harding M.M., Anderberg P.I., Haymet A.D.J. Гликопротеин «антифриз» полярных рыб. Биохим. 2003; 270:1381–1392. [PubMed] [Google Scholar]
84. Ван Дж.Х. Всесторонняя оценка эффектов и механизмов антифризных белков при низкотемпературном хранении. Криобиология. 2000;41:1–9. doi: 10.1006/cryo.2000.2265. [PubMed] [CrossRef] [Google Scholar]
85. Lee J.R., Youm H.W., Lee H.J., Suh C.H.S. Влияние антифризного белка на криоконсервацию и трансплантацию ткани яичника.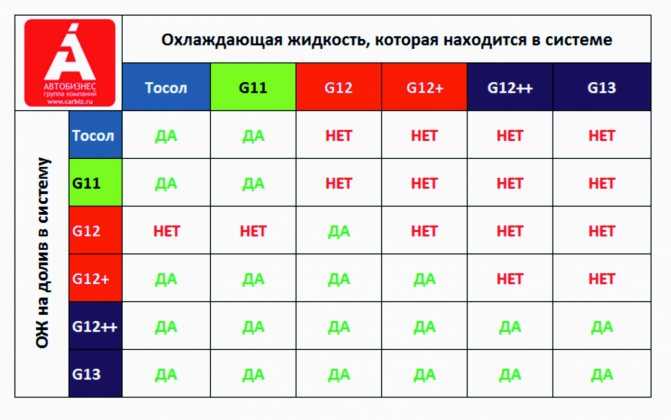 Йонсей Мед. Дж. 2015; 56: 778–784. дои: 10.3349/ymj.2015.56.3.778. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Йонсей Мед. Дж. 2015; 56: 778–784. дои: 10.3349/ymj.2015.56.3.778. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Liang S., Yuan B., Kwon J.W., Ahn M., Cui X.S., Bang J.K., Kim NH Эффект добавления антифриза гликопротеина 8 во время витрификации на способность к развитию бычьих ооцитов. Териогенология. 2016;86:485–494.e1. doi: 10.1016/j.theriogenology.2016.01.032. [PubMed] [CrossRef] [Google Scholar]
87. Багис Х., Актопраклигил Д., Меркан Х.О., Юрдусев Н., Тургут Г., Секмен С., Арат С., Цетин С. Стабильная передача и транскрипция ньюфаундленда Ген антифризного белка (АФП) рыбы океанской дудки типа III у трансгенных мышей и гипотермическое хранение трансгенных яичников и семенников. Мол. Воспр. Дев. 2006;73:1404–1411. doi: 10.1002/mrd.20601. [PubMed] [CrossRef] [Академия Google]
88. Джо Дж.В., Джи Б.К., Су К.С., Ким С.Х. Благотворное влияние белков-антифризов на витрификацию незрелых ооцитов мышей. ПЛОС ОДИН. 2012;7:e37043. doi: 10.1371/journal.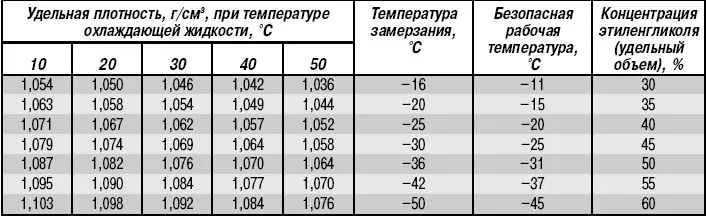 pone.0037043. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
pone.0037043. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Джо Дж.В., Джи Б.К., Ли Дж.Р., Сух С. Влияние среды для инвитрификации с добавками антифризного белка на способность мышиных ооцитов к развитию. Плодородный. Стерильно. 2011;96:1239–1245. doi: 10.1016/j.fertnstert.2011.08.023. [PubMed] [CrossRef] [Академия Google]
90. Чавес Д.Ф., Кампело И.С., Силва М., Бхат М.Х., Тейшейра Д.И.А., Мело Л.М., Соуза-Фабджан Дж.М.Г., Мермиллод П., Фрейтас В.Дж.Ф. Использование антифриза типа III для витрификации созревших in vitro ооцитов крупного рогатого скота. Криобиология. 2016;73:324–328. doi: 10.1016/j.cryobiol.2016.10.003. [PubMed] [CrossRef] [Google Scholar]
91. Zandiyeh S., Ebrahimi F., Sabbaghian M. Применение белка-антифриза при криоконсервации спермы. Малиновый паблик. 2018;1:22–34. doi: 10.31031/PRM.2018.01.000520. [Перекрестная ссылка] [Академия Google]
92. Zilli L., Beirão J., Schiavone R., Herraez M.P., Gnoni A. Сравнительный протеомный анализ криоконсервированных жгутиков и белка головной плазматической мембраны сперматозоидов морского леща: влияние антифризного белка. ПЛОС ОДИН. 2016;9:e99992. doi: 10.1371/journal.pone.0099992. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН. 2016;9:e99992. doi: 10.1371/journal.pone.0099992. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
93. Qadeer S., Khan M.A., Ansari M.S., Rakha B.A., Ejaz R., Iqbal R., Younis M., Ullah N., DeVries A.L. Эффективность антифризных гликопротеинов для криоконсервации Нили-Рави ( Bubalus bubalis ) сперма быка буйвола. Аним. Воспр. науч. 2015; 157:56–62. doi: 10.1016/j.anireprosci.2015.03.015. [PubMed] [CrossRef] [Google Scholar]
94. Кадир С., Хан М.А., Ансари М.С., Ракха Б.А., Эджаз Р., Хусна А.У., Ашик М., Икбал Р., Улла Н., Ахтер С. Оценка антифризного белка III для криоконсервации спермы буйволиного быка NiliRavi (Bubalus bubalis). Аним. Воспр. науч. 2014; 148:26–31. doi: 10.1016/j.anireprosci.2014.04.013. [PubMed] [CrossRef] [Академия Google]
95. Shaliutina-Kolešová A., Dietrich M., Xian M., Nian R. Влияние трансферрина семенной плазмы на криоконсервированную сперму карпа Cyprinus carpio и сравнение с бычьим сывороточным альбумином и антифризными белками.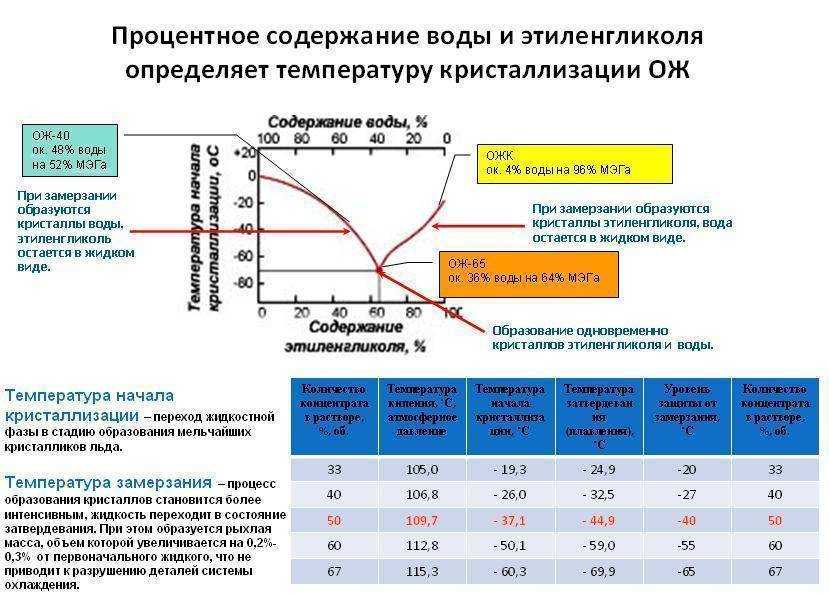 Аним. Воспр. науч. 2019;204:125–130. doi: 10.1016/j.anireprosci.2019.03.013. [PubMed] [CrossRef] [Google Scholar]
Аним. Воспр. науч. 2019;204:125–130. doi: 10.1016/j.anireprosci.2019.03.013. [PubMed] [CrossRef] [Google Scholar]
96. Martinez-Paramo S., Barbosa V., Perez-Cerezales S., Robles V., Herraez M.P. Криопротекторные эффекты белков-антифризов, доставленных в эмбрионы рыбок данио. Криобиология. 2009 г.;58:128–133. doi: 10.1016/j.cryobiol.2008.11.013. [PubMed] [CrossRef] [Google Scholar]
97. Амир Г., Рубинский Б., Кассиф Ю., Горовиц Л., Смолинский А.К., Лави Дж. Сохранение структуры миоцитов и целостности митохондрий при низкотемпературной криоконсервации сердец млекопитающих для трансплантация с использованием белков-антифризов — исследование с помощью электронной микроскопии. Евро. доц. Кардио-Торак. Surg. 2003; 24: 292–296. doi: 10.1016/S1010-7940(03)00306-3. [PubMed] [CrossRef] [Google Scholar]
98. Амир Г., Горовиц Л., Рубинский Б., Юсиф Б.С., Лави Дж., Смолинский А.К. Незамерзающая криоконсервация сердец крыс при отрицательных температурах с использованием антифризного протеина I и антифризного протеина III. Криобиология. 2004; 48: 273–282. doi: 10.1016/j.cryobiol.2004.02.009. [PubMed] [CrossRef] [Google Scholar]
Криобиология. 2004; 48: 273–282. doi: 10.1016/j.cryobiol.2004.02.009. [PubMed] [CrossRef] [Google Scholar]
99. Амир Г., Рубинский Б., Горовиц Л., Миллер Л., Леор Дж., Кассиф Ю., Мишали Д., Смолинский А.К., Лави Дж. Продлен 24 -часовая консервация гетеротопически трансплантированных крысиных сердец при температуре ниже нуля с использованием белков-антифризов, полученных из арктических рыб. Энн. Торак. Surg. 2004; 77: 1648–1655. doi: 10.1016/j.athoracsur.2003.04.004. [PubMed] [CrossRef] [Google Scholar]
100. Muldrew K., Rewcastle J., Donnelly B.J., Saliken J.C., Liang S., Goldie S., Olson M., Baissalov R., Sandison G. Антифризные пептиды Flounder повысить эффективность криохирургии. Криобиология. 2001; 42: 182–189.. doi: 10.1006/cryo.2001.2321. [PubMed] [CrossRef] [Google Scholar]
101. Багис Х., Аккоч Т., Тасс А., Ктопраклигил Д.А. Криогенное действие белка-антифриза на яичники трансгенных мышей и получение живого потомства путем ортотопической трансплантации криоконсервированных яичников мышей.