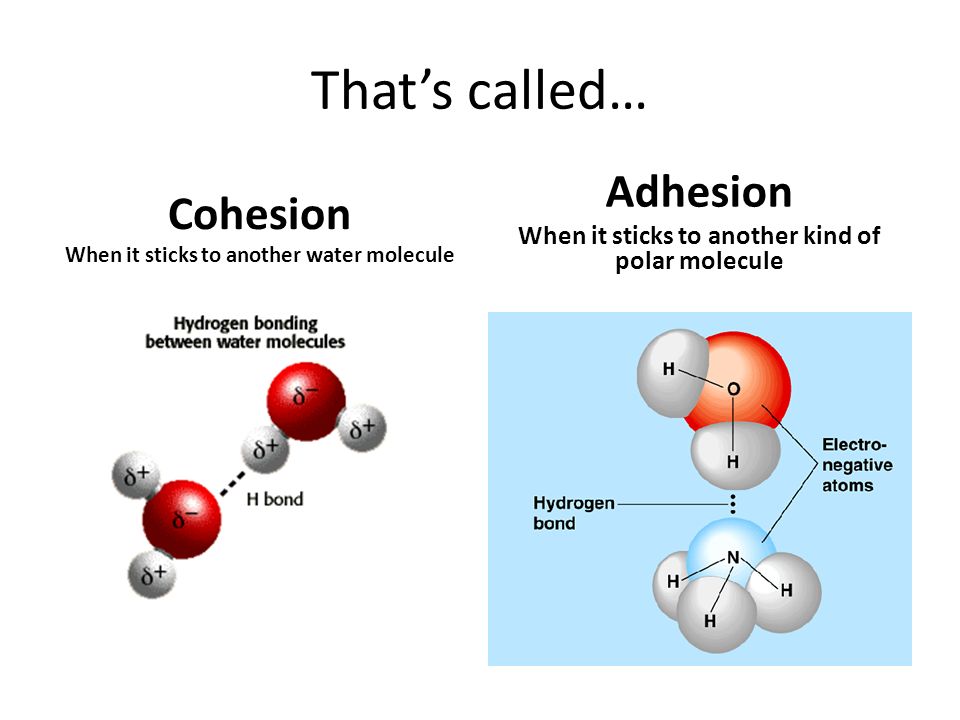
Когезия и адгезия
Явления смачивания и растекания тесно связаны с действием сил когезии и адгезии.
Когезией называют сцепление однородных молекул, атомов или ионов, которое включает все виды межмолекулярного и межатомного притяжения внутри одной фазы.
Когезия определяет существование веществ в конденсированном (твердом и жидком) состоянии. Такие состояния характеризуются высокой когезией. Газообразные вещества обладают малой когезией.
Адгезия (прилипание) – это молекулярное притяжение между поверхностями двух соприкасающихся разнородных твердых или жидких фаз. Адгезия является причиной склеивания двух разных веществ за счет действия физических или химических межмолекулярных сил.
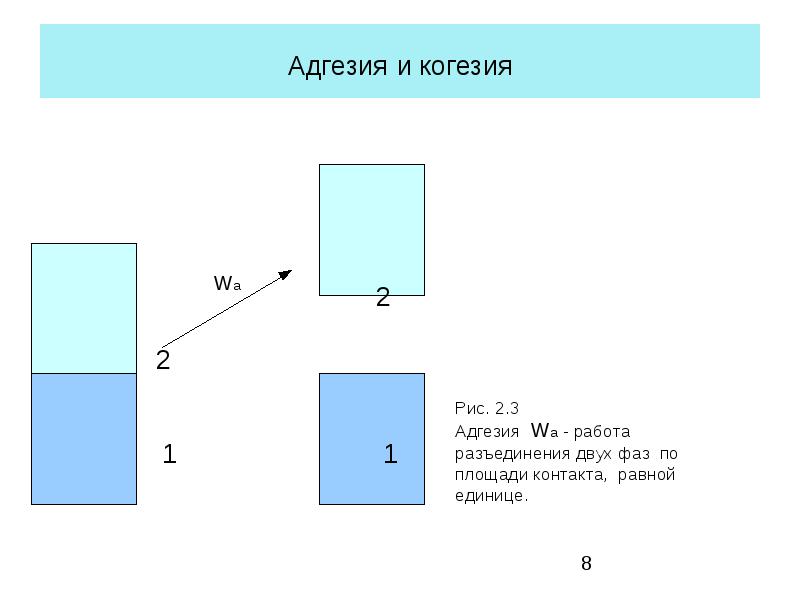
Количественно когезию и адгезию характеризуют величиной работы когезии Wc и работы адгезии Wa.
Работа когезии
равна энергии, которую нужно затратить
на разрыв сил сцепления между молекулами
данной фазы.
Wc = 2 · σ
Работа адгезии – это работа, затрачиваемая на отрыв молекул одной фазы от молекул другой фазы
Wa = σА + σВ + σАВ
σА – поверхностное натяжение на границе вещества А с воздухом
σВ – поверхностное натяжение на границе вещества В с воздухом
σАВ — поверхностное натяжение на границе веществ А и В
Из уравнения видно, что работа адгезии тем больше, чем больше поверхностное натяжение каждой из фаз на границе с воздухом и чем меньше поверхностное натяжение на границе раздела между фазами
Рассматриваемые
явления играют большую роль в таких
процессах, как смачивание материалов,
нанесение лакокрасочных и гальванических
покрытий, получение материалов на основе
связующих и наполнителей (бетон, резина,
стеклопластики и др. ), крашение, печатание,
сварка и металлов.
), крашение, печатание,
сварка и металлов.
Учитываются и используются адгезия и когезия в технологии лекарств, поскольку они влияют на взаимодействие компонентов в сложных лекарственных формах, на распадаемость таблеток, прочность покрытия их оболочками, на процессы растворения и в конечном итоге на эффективность терапевтического действия.
Заключение
К явлениям адсорбции близки явления смачивания и адгезии, определяющиеся интенсивностью взаимодействия между молекулами разных веществ. Количественными характеристиками смачивания являются краевой угол и теплота смачивания. По способности поверхностей избирательно смачиваться водой, их классифицируют на гидрофильные (θ < 90 0) и гидрофобные (θ > 90 0). Используя ПАВ можно провести инверсию смачивания.
Когезию и адгезию количественно оценивают работой, необходимой для разрыва связей между молекулами данной фазы или разных фаз.
Вопросы для самоконтроля
Чем обусловлено смачивание?
Что называется краевым углом смачивания? Как его определяют экспериментально?
Какие поверхности называют гидрофильными, гидрофобными?
Как можно осуществить инверсию смачивания?
Чем отличается когезия от адгезии?
Когезия — Словарь терминов | ПластЭксперт
Когезия
Понятие и общие сведения
Адгезия и когезия – основные виды межмолекулярного взаимодействия.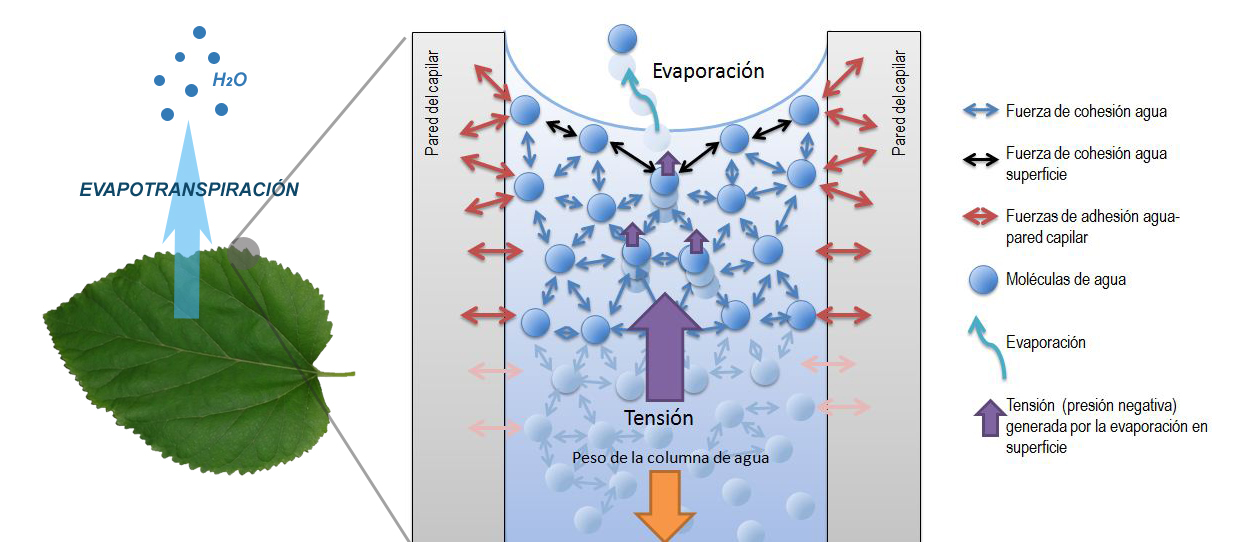
В многофазных или гетерогенных системах определенные силы могут возникать как в массе вещества каждой фазы, так и между разными фазами. Когезионным взаимодействием, в отличие от адгезии, считаются именно притяжение частиц вещества внутри конкретной фазы, но не межфазные силы. Именно когезия обуславливает существование тел и химических соединений веществ конденсированном состоянии. Силы когезии, которые также известны как силы притяжения или «аттракции» возникают из-за действия межмолекулярных, межатомных и межионных взаимодействий разнообразной природы.
Когезионные силы в целом состоят из суммы различных физических и физикохимических особенностей тела, например его агрегатного состояния, летучести, способности к растворению, физикомеханических характеристик т. д. Стоит отметить, что такого рода силы взаимодействия между частицами ослабевают с увеличением расстояния, поэтому когезия также ощутима только при ближайшем друг к другу расположении атомов, молекул и ионов. То же самое можно в целом сказать про адгезию.
д. Стоит отметить, что такого рода силы взаимодействия между частицами ослабевают с увеличением расстояния, поэтому когезия также ощутима только при ближайшем друг к другу расположении атомов, молекул и ионов. То же самое можно в целом сказать про адгезию.
Рис.1. Наглядная иллюстрация сил когезии (красные линии) и адгезии (синие линии).
В отличие от когезии, процесс адгезии – это стремление межфазной системы к постоянному снижению поверхностной энергии. Адгезия, которая также называется «прилипание», является по сути притяжением частиц на границе двух разнородных фаз (отсюда другое название клея – адгезив).
Характеристики когезионного взаимодействия
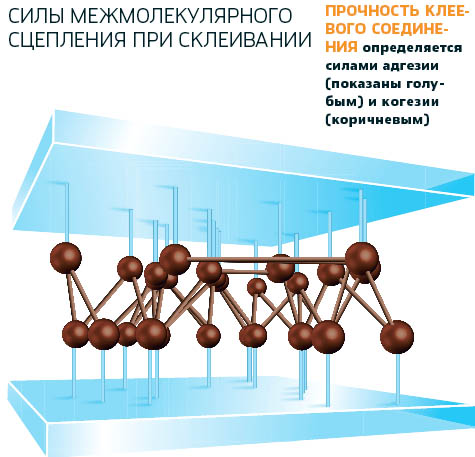 Из научных источников известно, что поверхностное натяжение границы конденсированной фазы с газовой фазой зависит от когезионного взаимодействия между частицами в самой конденсированной фазе. В целом когезия внутри такой фазы определяется как работа образования единицы поверхности. Работа когезии равна потраченной энергии на обратимое разрушение тела, причем поверхность такого сечения должна быть равна единице площади.
Из научных источников известно, что поверхностное натяжение границы конденсированной фазы с газовой фазой зависит от когезионного взаимодействия между частицами в самой конденсированной фазе. В целом когезия внутри такой фазы определяется как работа образования единицы поверхности. Работа когезии равна потраченной энергии на обратимое разрушение тела, причем поверхность такого сечения должна быть равна единице площади.Если рассматривать идеальное тело в твердом агрегатном состоянии, то величина работы когезии является обратимой прочностью на разрыв. Исходя из того, что когезия, в отличие от адгезии, описывает взаимодействие между частицами внутри гомогенной фазы, величину этого взаимодействия могут характеризовать следующие параметры:
2. Внутреннее давление.
3. Энергия парообразования.
4. Температура кипения.
5. Показатели летучести или равновесного давления пара над телом.
Те же самые данные, как известно, качественно и количественно описывают также поверхностное натяжение тел.
Адгезия и когезия – разница и сравнение
Когезия – это свойство одинаковых молекул (одного и того же вещества) прилипать друг к другу за счет взаимного притяжения. Адгезия — это свойство различных молекул или поверхностей прилипать друг к другу. Например, твердые тела обладают высокими когезионными свойствами, поэтому они не прилипают к поверхностям, с которыми соприкасаются. С другой стороны, газы имеют слабое сцепление. Вода обладает как когезионными, так и адгезивными свойствами. Молекулы воды прилипают друг к другу, образуя сферу. Это результат действия связующих сил. При содержании в трубке молекулы воды, соприкасающиеся с поверхностью сосуда, находятся на более высоком уровне (см.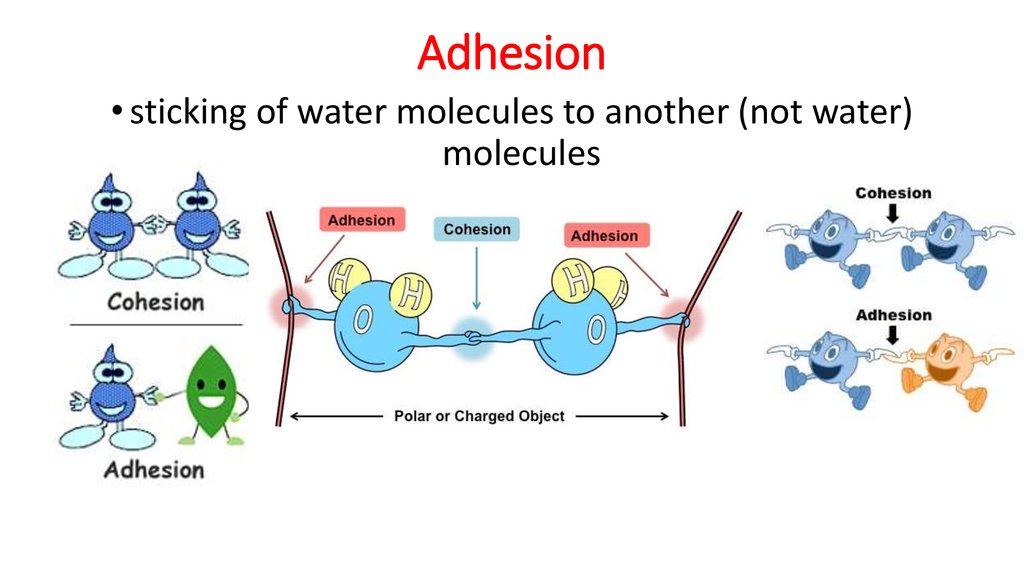
Сравнительная таблица
| Адгезия | Когезия | |
|---|---|---|
| Компоненты | Разнородные молекулы | Подобные молекулы |
| Эффект | Капиллярное действие, мениск | Поверхностное натяжение, капиллярное действие и мениск |
Эффекты когезии и адгезии
Поверхностное натяжение
Поверхностное натяжение является результатом сил сцепления между соседними молекулами. Молекулы в объеме жидкости одинаково притягиваются соседними молекулами во всех направлениях. Но поверхностные молекулы не имеют молекул со всех сторон. Следовательно, они втягиваются внутрь, заставляя жидкость сжиматься, образуя поверхность с минимальной площадью, сферу.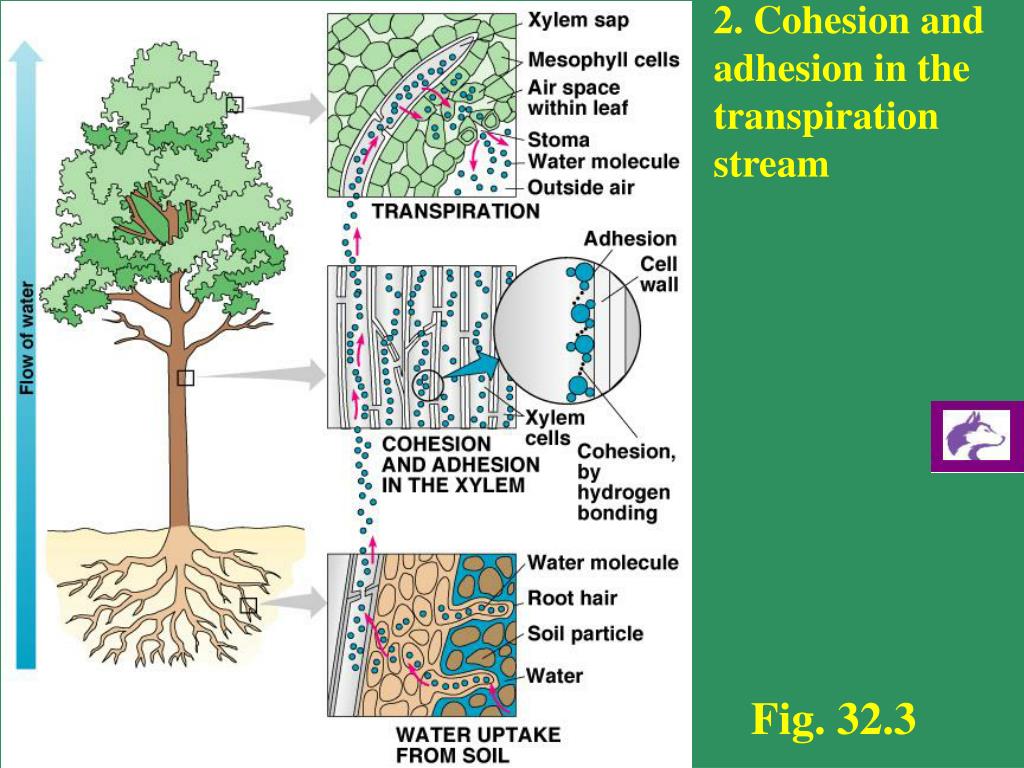
Молекулы воды слипаются на вощеной бумаге, потому что поверхностное натяжение больше, чем силы сцепления между бумагой и молекулами воды.
Поверхностное натяжение воды позволяет объектам тяжелее нее плавать по ней. Когда молекулы воды не прилипают к объекту (не смачивается) и вес объекта меньше сил поверхностного натяжения.
Мениск
Вогнутый и выпуклый мениск. Мениск вогнут, когда силы сцепления больше, чем силы сцепления. например вода. Он выпуклый, когда сцепление сильнее. например ртуть
Изогнутая поверхность жидкости внутри сосуда называется мениском.
- Когда силы сцепления между молекулами жидкости больше, чем силы сцепления между жидкостью и стенкой сосуда, поверхность жидкости выпуклая. Например, Меркурий в контейнере.

- Когда силы сцепления между жидкостью меньше, чем силы сцепления между жидкостью и контейнером, поверхность изгибается вверх. Например, вода в стеклянной посуде.
- Когда силы сцепления и силы сцепления равны, поверхность горизонтальна. Например, дистиллированная вода в серебряном сосуде.
Капиллярное действие
Капиллярное действие является результатом когезионных и адгезионных сил. Когда жидкость течет через узкое пространство, когезионная и адгезионная силы действуют вместе, поднимая ее против естественной силы гравитации. Смачивание бумажного полотенца, стекание воды от корней к верхушке растения — вот несколько примеров капиллярного действия.
Ртуть лучше сцепляется со стеклом, чем слипается.
Когезия заставляет воду образовывать капли, поверхностное натяжение делает их почти сферическими, а адгезия удерживает капли на месте.
Области применения
Адгезия используется для надлежащего функционирования клея, краски, смолы, цемента, чернил и т. д. Адгезионные и когезионные силы вместе вызывают капиллярное действие, которое является принципом, используемым в фитилях ламп. Синтетические волокна используют влагоотведение для удаления пота с кожи.
д. Адгезионные и когезионные силы вместе вызывают капиллярное действие, которое является принципом, используемым в фитилях ламп. Синтетические волокна используют влагоотведение для удаления пота с кожи.
Ссылки
- Сплоченность – выдержка из Общая наука
- Википедия:Слипание
- Wikipedia:Cohesion_(химия)
- Wikipedia:Surface_tension#Причины
- Википедия:Капиллярное действие
- Силы сцепления и сцепления — ThinkQuest.org
- Подписаться
- Поделиться
- Укажите
- Авторы
Поделитесь этим сравнением:
Если вы дочитали до этого места, подписывайтесь на нас:
«Сплоченность против сплоченности». Diffen.com. Diffen LLC, nd Веб. 5 декабря 2022 г. < >
Силы сцепления и сцепления — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1499
Силы сцепления и адгезии связаны с объемными (или макроскопическими) свойствами, и, следовательно, эти термины неприменимы к обсуждению атомарных и молекулярных свойств. Когда жидкость вступает в контакт с поверхностью (например, со стенками градуированного цилиндра или столешницей), на нее действуют как силы сцепления, так и силы сцепления. Эти силы управляют формой, которую принимает жидкость. Из-за действия сил сцепления жидкость на поверхности может растекаться, образуя тонкую, относительно однородную пленку по поверхности, этот процесс известен как смачивание. В качестве альтернативы, при наличии сильных когезионных сил, жидкость может разделиться на несколько небольших, примерно сферических шариков, которые стоят на поверхности, сохраняя минимальный контакт с поверхностью.
Когда жидкость вступает в контакт с поверхностью (например, со стенками градуированного цилиндра или столешницей), на нее действуют как силы сцепления, так и силы сцепления. Эти силы управляют формой, которую принимает жидкость. Из-за действия сил сцепления жидкость на поверхности может растекаться, образуя тонкую, относительно однородную пленку по поверхности, этот процесс известен как смачивание. В качестве альтернативы, при наличии сильных когезионных сил, жидкость может разделиться на несколько небольших, примерно сферических шариков, которые стоят на поверхности, сохраняя минимальный контакт с поверхностью.
Адгезионные и когезионные силы
Термин «когезионные силы» является общим термином для коллективных межмолекулярных сил (например, водородных связей и сил Ван-дер-Ваальса), ответственных за объемное свойство жидкостей, сопротивляющихся разделению. Именно эти силы притяжения существуют между молекулами одного и того же вещества. Например, дождь падает каплями, а не мелким туманом, потому что вода обладает сильным сцеплением, которое плотно стягивает ее молекулы, образуя капли. Эта сила стремится объединить молекулы жидкости, собирая их в относительно большие кластеры из-за неприязни молекул к окружающей среде.
Эта сила стремится объединить молекулы жидкости, собирая их в относительно большие кластеры из-за неприязни молекул к окружающей среде.
Аналогичным образом, термин «адгезионные силы» относится к силам притяжения между разнородными веществами, таким как механические силы (слипание друг с другом) и электростатические силы (притяжение из-за противоположных зарядов). В случае жидкого смачивающего агента адгезия заставляет жидкость прилипать к поверхности, на которой она находится. Когда воду наливают на чистое стекло, она имеет тенденцию растекаться, образуя тонкую равномерную пленку на поверхности стекла. Это связано с тем, что силы сцепления между водой и стеклом достаточно сильны, чтобы вытащить молекулы воды из их сферического образования и удерживать их на поверхности стекла, тем самым избегая отталкивания между подобными молекулами.
Макроскопические эффекты когезионных и адгезионных сил
Когда жидкость помещается на гладкую поверхность, относительная сила когезионных и адгезионных сил, действующих на эту жидкость, определяет форму, которую она примет (и будет ли она смачивать поверхность или нет ). Если силы сцепления между жидкостью и поверхностью сильнее, они будут тянуть жидкость вниз, заставляя ее смачивать поверхность. Однако, если силы сцепления между самой жидкостью сильнее, они будут препятствовать такому слипанию и заставят жидкость сохранять сферическую форму и выпуклость на поверхности.
Если силы сцепления между жидкостью и поверхностью сильнее, они будут тянуть жидкость вниз, заставляя ее смачивать поверхность. Однако, если силы сцепления между самой жидкостью сильнее, они будут препятствовать такому слипанию и заставят жидкость сохранять сферическую форму и выпуклость на поверхности.
Случай I: Мениск
Мениск представляет собой кривизну поверхности жидкости внутри сосуда, такого как мерный цилиндр. Однако, прежде чем мы объясним, почему у некоторых жидкостей мениск вогнут вверх, а у других мениск вогнут вниз, мы должны понять силы сцепления, действующие на поверхностное натяжение. Вода, например, представляет собой полярную молекулу, состоящую из частичного положительного заряда атомов водорода и частичного отрицательного заряда кислорода. Таким образом, в жидкой воде частичный положительный заряд каждой молекулы притягивается к частичному отрицательному заряду соседней молекулы. Это источник сил сцепления в воде. Молекулы воды, погруженные в жидкость, затем вытягиваются и равномерно выталкиваются во всех направлениях, не создавая чистого притяжения.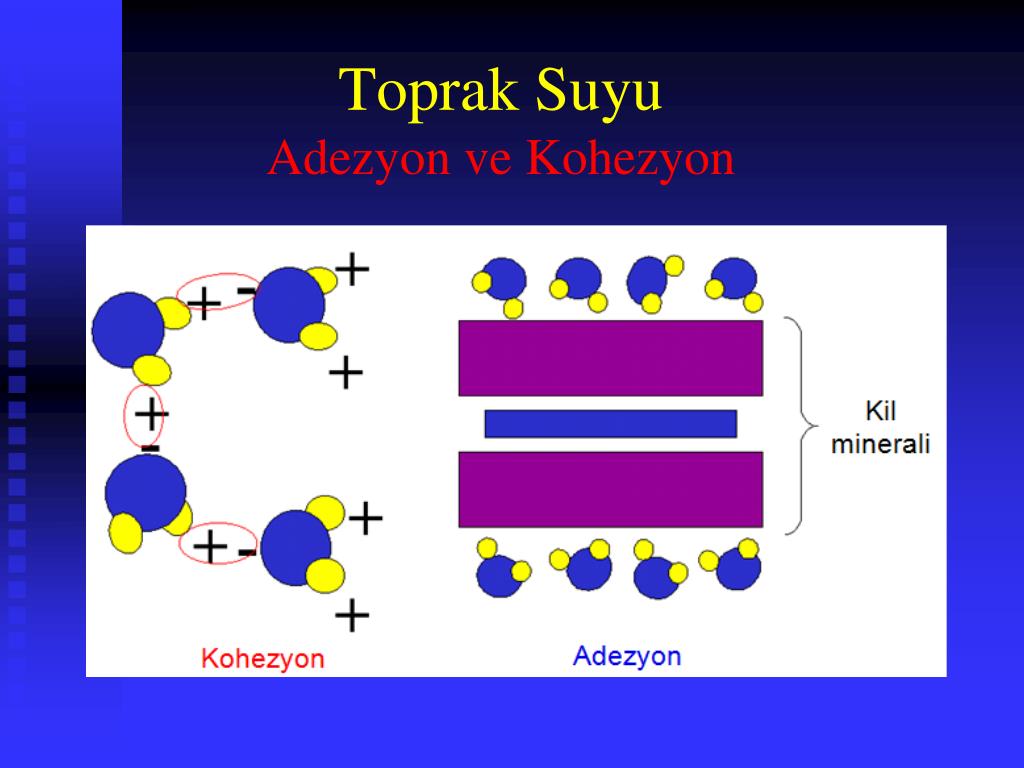 Между тем, молекулы на поверхности жидкости, лишенные сил притяжения в восходящем направлении, таким образом охватывают результирующее притяжение вниз.
Между тем, молекулы на поверхности жидкости, лишенные сил притяжения в восходящем направлении, таким образом охватывают результирующее притяжение вниз.
Как тогда эта сила сцепления создает и вогнутую вверх, и вогнутую вниз поверхность? Ответ заключается в его отношении к силе сцепления между молекулами воды и поверхностью контейнера. Когда сила сцепления жидкости больше, чем сила сцепления жидкости со стенкой, жидкость вогнута вниз, чтобы уменьшить контакт с поверхностью стенки. Когда сила сцепления жидкости со стенкой больше, чем сила сцепления жидкости, жидкость сильнее притягивается к стенке, чем ее соседи, вызывая вогнутость вверх.
Случай II: Слезы вина
В встряхиваемых бокалах с вином капли вина как бы «плавают» над мениском жидкости и образуют «слезы». Это вековое явление является результатом поверхностного натяжения и когезионных и адгезионных сил. Спирт более летуч, чем вода. В результате «испарение спирта создает градиент поверхностного натяжения, поднимающий тонкую пленку вдоль стенок бокала» (Адамсон).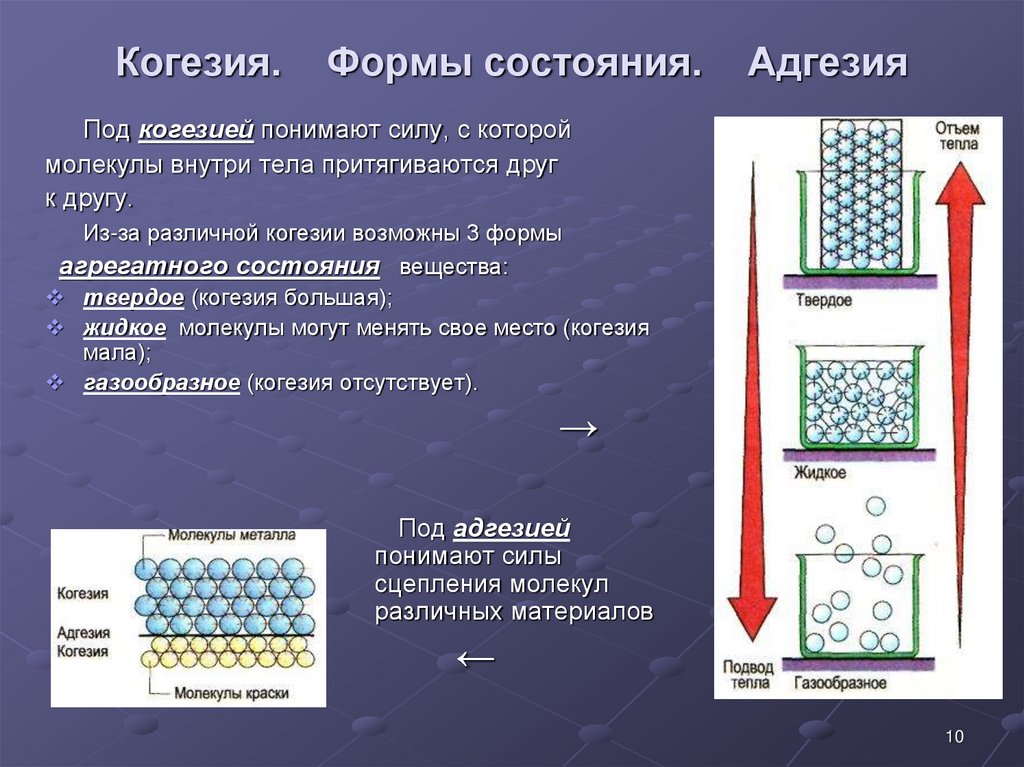 Этот процесс называется «солютным эффектом Марангони». 2 За счет сил сцепления часть воды прилипает к стенкам стакана. «Слезы» образуются из-за сил сцепления внутри воды, удерживающих ее вместе. Важно отметить, что градиент поверхностного натяжения является «движущей силой движения жидкости» (Гульотти), но фактическое образование разрывов является результатом когезионных и адгезионных сил.
Этот процесс называется «солютным эффектом Марангони». 2 За счет сил сцепления часть воды прилипает к стенкам стакана. «Слезы» образуются из-за сил сцепления внутри воды, удерживающих ее вместе. Важно отметить, что градиент поверхностного натяжения является «движущей силой движения жидкости» (Гульотти), но фактическое образование разрывов является результатом когезионных и адгезионных сил.
Задачи
- Назовите два примера, где сила сцепления преобладает над силой сцепления и наоборот.
- В стеклянном градуированном цилиндре вода представляет собой вогнутый вверх мениск. Однако, когда вода заполнена до кончика цилиндра, уровень воды может поддерживаться выше стенки цилиндра, не выливаясь, напоминая вогнутый вниз мениск.
 Используйте принципы когезионных и адгезионных сил, чтобы объяснить эту ситуацию.
Используйте принципы когезионных и адгезионных сил, чтобы объяснить эту ситуацию. - Объясните, почему водомер может скользить по воде, зная сцепление в воде.
- Предложите различные типы сил, на которых могут основываться силы сцепления.
Ответы
- Когда сила сцепления больше, чем сила сцепления: вогнутый мениск, вода образует капли на поверхности. Когда сила сцепления больше, чем сила сцепления: мениск вогнут вниз, поверхности покрыты смачивающим веществом, последние капли жидкости в бутылке всегда отказываются выходить.
- Поскольку вода образует вогнутый мениск, сцепление молекул со стеклом сильнее, чем сцепление между молекулами. Однако при отсутствии силы сцепления (когда вода достигает кончика стакана) сила сцепления остается. Таким образом, сила сцепления сама по себе доказывает, что она еще может удерживать себя на месте, не вытекая из цилиндра. Этот пример подчеркивает важность того, что силы сцепления и силы сцепления не просто компенсируют друг друга, но именно разница между ними определяет характеристики жидкости.
- Эта задача еще раз обращается к концепции поверхностного натяжения. Поскольку сцепление воды основано на слабых межмолекулярных силах воды, когда водомерка выходит на поверхность, потребуется дополнительная энергия, чтобы преодолеть эти связи, чтобы увеличить площадь поверхности. Более того, поскольку гравитационное притяжение водомерки не может преодолеть энергию активации, чтобы разрушить эти межмолекулярные силы, водомерка может свободно скользить по воде.
- Дополнительная форма, образование химических связей, слабые межмолекулярные силы, такие как Н-связь или силы Ван-дер-Ваальса.
Ссылки
- Петруччи и др. Общая химия: принципы и современные приложения: AIE (твердый переплет). Река Аппер-Сэдл: Пирсон / Прентис-Холл, 2007 г. .
- Гуглиотти, Маркос. «Слезы вина». Журнал химического образования 81.1 (2004): 67-68. Веб. 9 марта 2010 г.
- Адамсон, А. В.; Гаст, А. П. Физическая химия поверхностей , 6-е изд.

